IEC 82304開発でAI医療機器を成功させるには|規格対応から薬事承認まで

「IEC 82304開発でAI医療機器を作りたいけど、何から始めればいいの?」「画像診断支援AIの薬事申請って複雑そう…」「医用画像診断支援システム開発ガイドラインとの関係がよくわからない」そんな悩みを抱えている開発者の方も多いのではないでしょうか。
実は、IEC 82304開発におけるAI医療機器の成功には、PMDAの薬事承認プロセスを理解し、SaMD開発ガイダンスに準拠した体系的なアプローチが不可欠です。エルピクセル株式会社が9製品で薬事承認を取得し、630施設以上への導入を実現した背景には、IEC 82304-1への適切な対応と、主たる機能をAIの活用により開発されたプログラム医療機器としての要件を満たす開発プロセスがありました。
本記事では、IEC 82304開発におけるAI医療機器の具体的な成功戦略について、実際の承認事例と薬事申請のポイントを詳しく解説していきます。AI医療機器一覧に名を連ねる製品の開発手法から、将来的なGMLP対応まで、開発者が知っておくべき実践的な情報をお届けします。
- IEC 82304開発でAI医療機器の薬事承認を取得する具体的な手順とPMDA審査のポイント
- 画像診断支援AIと医用画像診断支援システム開発ガイドラインに準拠した開発プロセス
- 主たる機能をAIの活用により開発されたプログラム医療機器の成功事例と実践的な対応策
- SaMD開発ガイダンスとIEC 82304-1の関係性、AI医療機器一覧に掲載される製品の開発手法
- 継続学習機能を持つAI医療機器の市販後監視体制とIDATEN活用による変更管理プロセス
IEC 82304開発におけるAI医療機器の重要性と市場動向
AI医療機器市場の急成長と開発課題
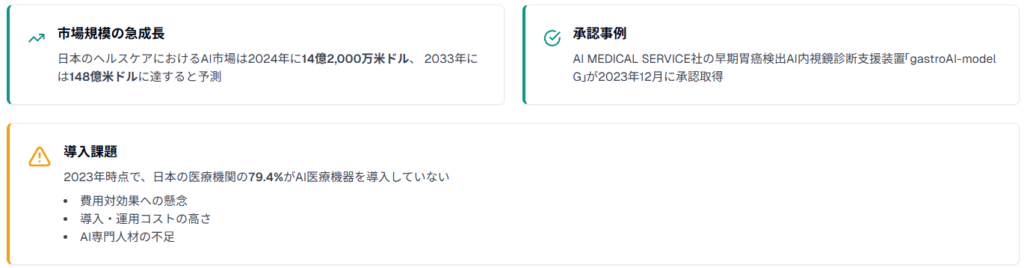
国内のAI医療機器市場は急速な成長を遂げており、日本のヘルスケアにおけるAI市場は2024年に14億2,000万米ドル(約2,100億円)に達し、2033年には148億米ドル(約2兆2,000億円)に達すると予測されています。
AI MEDICAL SERVICE社が開発した早期胃癌検出AI内視鏡診断支援装置「gastroAI-model G」は、2023年12月26日にAIを活用した早期胃癌検出支援医療機器として承認を取得しました。この装置は内視鏡検査中に早期胃癌の疑いがある病変候補を検出し、医師の診断を支援します。
しかし、2023年時点で、日本の医療機関の79.4%がAI医療機器を導入していない状況です。主な理由として、費用対効果への懸念、導入・運用コストの高さ、AI専門人材の不足が挙げられており、開発者にとってはこれらの課題を解決する製品設計が重要となっています。
- 日本のAIヘルスケア市場規模:14億2,000万米ドル(2024年)
- AI医療機器未導入医療機関:79.4%(2023年時点)
- 早期胃癌検出AI内視鏡診断支援装置:2023年12月26日承認取得
IEC 82304-1がAI医療機器開発に必要な理由

IEC 82304-1は、ヘルスソフトウェアの製品安全に関する一般要求事項を規定する国際規格です。2021年にJIS T 82304-1として国内規格化され、AI医療機器の安全性確保において中核的な役割を果たしています。サイバネットシステム株式会社のEndoBRAINシリーズは、2018年から2020年にかけて複数の内視鏡画像診断支援AI製品でPMDA承認を取得し、IEC 82304-1準拠の重要性を実証しました。
AI特有のリスクとして、学習データのバイアス、アルゴリズムの予期せぬ挙動、継続学習による性能変化などが挙げられます。
これらのリスクに対してIEC 82304-1は、体系的なリスクマネジメントプロセスと継続的な監視体制の確立を要求しており、AI医療機器の安全性と有効性を担保する枠組みを提供しています。
- 体系的なリスクマネジメントプロセスの確立
- 継続的な監視体制の構築
- AI特有のリスクへの対応策の明確化
日本の薬事規制とAI医療機器の位置づけ
日本の薬事規制では、AI医療機器はプログラム医療機器(SaMD:Software as a Medical Device)として分類されます。PMDAはAI医療機器の評価に特有の項目を明確にしています。
エルピクセル株式会社のEIRL Colon Polypは、大腸内視鏡画像から大腸ポリープの候補を検出するAI医療機器として2022年11月に承認され、深層学習を活用したプログラム医療機器としての成功例です。
厚生労働省は2023年3月に基本要件基準を改正し、サイバーセキュリティに関する要求事項を追加しました。この改正により、IEC 81001-5-1:2021への適合が実質的に必要となり、AI医療機器開発におけるセキュリティ対策の重要性が一層高まっています。
 ReAlice株式会社 開発担当者
ReAlice株式会社 開発担当者サイバーセキュリティ対策は機能要件でなく薬事要件として不可欠であり、設計初期からの組込みが必須です。
IEC 82304-1規格の基本理解とAI開発への適用
IEC 82304-1(JIS T 82304-1)の概要と対象範囲


IEC 82304-1は、汎用コンピューティングプラットフォームで動作し、専用ハードウェアなしで市場出荷するヘルスソフトウェアの製品安全に関する要求事項を規定しています。対象範囲にはSaMD(Software as a Medical Device)が含まれ、AI医療機器開発において業界のベストプラクティスとして採用されています。
株式会社NTTデータとメッドサポートシステムズが共同開発した脳MRI画像診断AI技術は、2019年より開発が開始され、エルピクセルとの提携により製品化が進められています。
規格の適用範囲は、医療機器として規制対象となるソフトウェアだけでなく、健康関連のソフトウェア全般を包含しています。ただし、IEC 82304-1を適用する場合は、IEC 62304(医療機器ソフトウェア-ソフトウェアライフサイクルプロセス)のサブセットも同時に適用する必要があります。
SaMD(Software as a Medical Device)として分類されるAI医療機器が主な対象
IEC 62304のサブセットとの併用が必要となる領域
IEC 62304との関係性と相違点
IEC 82304-1とIEC 62304は相補的な関係にあり、AI医療機器開発では両規格への適合が求められます。
IEC 62304がソフトウェア開発プロセスに焦点を当てるのに対し、IEC 82304-1は製品安全とリスクマネジメントを重視しています。gMendel社は、遺伝性疾患の診断支援AIシステム開発において、IEC 62304準拠のソフトウェア開発ライフサイクルを確立し、診断時間を数か月から数時間へと大幅に短縮することに成功しました。
両規格の主要な相違点は、IEC 82304-1がサイバーセキュリティ、ユーザビリティ、市販後監視に特化した要求事項を含むことです。特にAI医療機器では、継続的な学習機能やアルゴリズムの更新に対する管理プロセスが重要となります。
ヘルスソフトウェアとSaMDの定義と分類
ヘルスソフトウェアは、健康関連の目的で使用されるソフトウェア全般を指し、その中でも医療機器として規制されるものがSaMDです。PMDAのガイダンスでは、SaMDをGHTFクラス分類ルールに基づいて4つのカテゴリーに分類しています。富士フイルムのCOVID-19肺炎画像解析プログラムFS-AI693型は、CT画像からCOVID-19肺炎の可能性を3段階で評価するクラスIIbのSaMDとして承認されました。
分類の判断基準は、プログラムにより得られた結果の重要性と、機能障害が生じた場合の人体への影響度です。アイリス株式会社のnodoca(ノドカ)は、咽頭画像と体温等を解析してインフルエンザの特徴的所見を検出する新医療機器として2022年4月に承認され、AI医療機器の新たな分野を開拓しました。



AIによる診断支援のような臨床影響の大きい機器では、ユーザビリティと製品アップデート時の再検証体制がリスク管理に直結します。
AI医療機器開発特有の課題とIEC 82304対応戦略
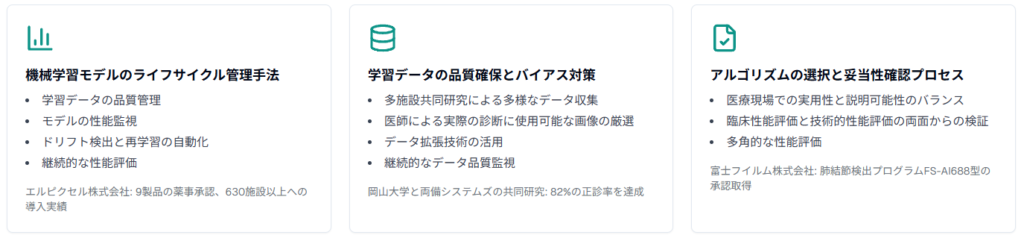

機械学習モデルのライフサイクル管理手法
AI医療機器開発において、機械学習モデルのライフサイクル管理は最も重要な課題の一つです。
エルピクセル株式会社は、学習データの品質管理からモデルの性能監視まで一貫したライフサイクル管理体制を構築しました。同社は2024年時点で9製品の薬事承認を取得し、630施設以上への導入実績を持つことから、その管理手法の有効性が実証されています。
機械学習モデルの継続的な性能監視には、ドリフト検出とモデル再学習の自動化が不可欠です。株式会社両備システムズの早期胃癌深達度AI診断支援システムでは、1枚の画像から多様なパターンの画像を生成してAIに学習させる手法を採用し、82%の高い正診率を実現しました。
学習データの品質確保とバイアス対策
学習データの品質は、AI医療機器の性能と安全性を左右する重要な要素です。岡山大学と両備システムズの共同研究では、医師が診断に実際に使用できる画像を厳選し、様々な条件下での内視鏡検査に対応するためのデータ拡張技術を活用しました。この取り組みにより、従来の専門医による正診率72%を上回る82%の精度を達成しています。
データバイアス対策として、多施設共同研究による多様なデータ収集が効果的です。サイバネットシステム株式会社のEndoBRAINシリーズは、複数の医療機関から収集した大腸内視鏡画像を用いて開発され、2018年から2020年にかけて複数の関連製品でPMDA承認を取得しました。
- 多施設共同研究による多様なデータ収集
- 医師による実際の診断に使用可能な画像の厳選
- データ拡張技術を活用した多様な撮影条件への対応
- 継続的なデータ品質監視とバイアス検出
アルゴリズムの選択と妥当性確認プロセス
アルゴリズムの選択では、医療現場での実用性と説明可能性のバランスが重要です。富士フイルム株式会社は、肺結節検出プログラムFS-AI688型において、胸部CT画像から肺結節の候補を自動で検出し、検出箇所をマークして表示する機能を実装し、放射線科医の診断プロセスを支援する設計を採用しました。同社は2020年から2021年にかけて複数のAI医療機器で承認を取得し、実用的なアルゴリズム設計の重要性を示しています。
妥当性確認では、臨床性能評価と技術的性能評価の両面からの検証が必要です。コニカミノルタ株式会社のKDSS-CXR-AI-101は、胸部エックス線画像から結節影と浸潤影を検出する機能で承認を取得し、多角的な性能評価の成功例となっています。
AIリスクマネジメントの実装方法
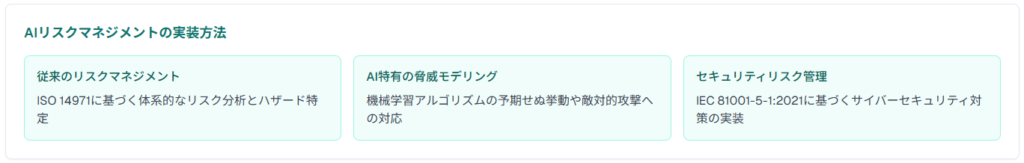

AI医療機器のリスクマネジメントでは、従来の医療機器リスクに加えて、AI特有のリスクへの対応が求められます。シーメンスヘルスケア株式会社のAI-Rad Companionは、CT画像上で臓器の輪郭を自動描出する機能を持つシステムとして2021年12月にFDAクリアランスを取得し、包括的なリスクマネジメント体制の構築例となっています。
リスクマネジメントプロセスでは、ISO 14971に基づく従来のアプローチに、AI特有の脅威モデリングを統合することが効果的です。IEC 81001-5-1:2021では、セキュリティリスクマネジメントの具体的な手法が規定されており、AI医療機器開発において参考となります。
AI特有のリスク特定と評価手法
AI特有のリスクには、アルゴリズムの予期せぬ挙動、学習データの偏り、敵対的攻撃への脆弱性などがあります。株式会社CESデカルトのCOVID-19肺炎画像解析AIプログラムInferRead CT Pneumoniaは、CT画像からCOVID-19肺炎の可能性を3段階で評価する機能で2020年6月に承認され、パンデミック対応におけるAI医療機器の迅速な実用化を実現しました。
リスク評価では、ハザード分析とFMEA(故障モード影響解析)を組み合わせた手法が有効です。
日本電気株式会社(NEC)のWISE VISION内視鏡画像解析AIは、大腸前がん病変の検出において音とマーキングによる警告機能を実装し、誤検出リスクの軽減策を講じています。
誤判断リスクの管理策と対応プロセス
AI医療機器における誤判断リスクの管理には、ヒューマンファクターエンジニアリングの観点が重要です。
富士フイルム株式会社のEW10-EC02は、内視鏡画像から大腸ポリープの病変検出支援と疾患鑑別支援の両機能を提供し、医師の最終判断を支援する設計を採用しています。
誤判断への対応プロセスでは、リアルタイムでの性能監視と迅速なフィードバック機能が不可欠です。エルピクセル株式会社のEIRL Colon Polypは、大腸内視鏡画像からポリープ候補を検出する際に、検出根拠の可視化機能を実装し、医師による検証を容易にしています。
- リアルタイム性能監視システムの構築
- 検出根拠の可視化機能による透明性確保
- 医師による最終判断を支援する設計
- 迅速なフィードバック機能の実装
説明可能性とユーザビリティの確保


AI医療機器の説明可能性は、医師の信頼獲得と適切な使用において重要な要素です。株式会社ドクターネットの胸部X線肺炎検出エンジンDoctorNet JLK-CRPは、感染性肺炎の可能性を3段階で表示し、関連領域をマーキングする機能により、診断根拠の透明性を確保しています。
ユーザビリティの設計では、医療現場のワークフローとの整合性が重要です。
キヤノンメディカルシステムズ株式会社のCOVID-19肺炎解析ソフトウェアSCO-PA01は、既存のCTワークステーションとの統合により、医師の作業負荷を最小限に抑える設計を実現しています。
AIの判断根拠提示機能の設計
判断根拠の提示機能では、医師の診断プロセスに適合した情報表示が求められます。富士通Japan株式会社のHOPE LifeMark-CAD肺炎画像解析支援プログラムは、COVID-19肺炎の可能性を3段階で表示し、関連領域をマーキングする機能により、直感的な理解を促進する設計を採用しました。
ヒートマップやアテンションマップを用いた可視化技術は、AI医療機器の説明可能性向上に効果的です。
富士フイルムの胸部エックス線画像病変検出プログラムLU-AI689型は、肺結節や気胸の候補領域をヒートマップで表示し、放射線科医の診断支援を行っています。
医療従事者向けインターフェース設計
医療従事者向けインターフェースでは、直感的な操作性と情報の階層化が重要です。
島津メディカルシステムズ株式会社とエルピクセルの販売提携により展開されるEIRL Chest Screeningは、胸部X線画像診断支援において、医師の既存ワークフローに自然に統合される設計を実現しています。
インターフェース設計では、IEC 62366-1(医療機器のユーザビリティエンジニアリング)への準拠が求められます。エルピクセルのEIRL Platformは、複数の国内主要PACSメーカーとの接続実績を持ち、医療機関での導入障壁を最小化する統合設計を採用しています。



継続学習・性能監視・ドリフト検知の自動化は、安全性を損なわずAIの進化を取り込む鍵です。
モデル設計では、説明可能性とワークフロー適合性の両立が、現場導入の可否を左右します。
IEC 82304準拠のAI医療機器開発プロセス実践ガイド


要求定義フェーズでのAI特有の考慮事項
AI医療機器の要求定義では、従来の医療機器開発に加えて、機械学習アルゴリズムの性能要件と継続的な学習機能への対応が重要です。gMendel社のヘルステックソフトウェア開発では、IEC 62304準拠のソフトウェア開発ライフサイクルを確立し、遺伝性疾患の診断時間を数か月から数時間へと大幅に短縮することに成功しました。この成果は、要求定義段階での適切な性能指標設定と継続的な改善プロセスの確立によるものです。
要求定義では、医療現場での実用性と規制要件のバランスを考慮する必要があります。株式会社MDAコンサルティングが提供するプログラム医療機器の設計開発手順書では、ISO 13485、ISO 14971、IEC 62366-1、IEC 81001-5-1の各規格との連携を重視した要求定義プロセスが示されています。
AI医療機器の診断支援機能、検出精度、処理速度などの性能指標を具体的に定義
IEC 62366-1に基づく使用エラー防止とユーザーインターフェース設計要件
IEC 82304-1、ISO 14971、IEC 81001-5-1への適合性を考慮した設計要件
設計・開発段階でのIEC 82304要求事項の実装
設計・開発段階では、IEC 82304-1の要求事項をソフトウェアアーキテクチャに組み込む必要があります。
エルピクセル株式会社は、EIRL AI パートナープログラムを通じて、NTTデータが開発した脳MRI診断支援AI技術の製品化を進めており、医療機器品質マネジメントシステムに対応した製品開発プロセスを確立しています。同社の9製品の薬事承認実績は、体系的な設計・開発プロセスの有効性を示しています。
セキュリティ要件の実装では、IEC 81001-5-1:2021への準拠が重要です。PMDAが公開した説明会資料によると、サイバーセキュリティに関する要求事項が基本要件基準に追加され、医療機器開発において必須の考慮事項となっています。
- ソフトウェアアーキテクチャへの安全要件の組み込み
- サイバーセキュリティ対策の実装(IEC 81001-5-1準拠)
- ユーザーインターフェース設計でのIEC 62366-1適用
- 継続的な学習機能への対応策の実装
検証・妥当性確認の具体的手法
AI医療機器の検証・妥当性確認では、技術的性能評価と臨床性能評価の両面からのアプローチが必要です。
岡山大学と両備システムズの早期胃癌深達度AI診断支援システムでは、単体性能評価試験により82%の正診率を実証し、従来の専門医による72%を上回る性能を確認しました。この成果は、多様な撮影条件に対応するデータ拡張技術と厳格な性能評価プロセスによるものです。
検証プロセスでは、FDA Guidance for Software Validationに準拠したテスト戦略の採用が効果的です。テストスクリプト、テストデータ、テストログの体系的な管理手法により、AI医療機器開発における品質保証の重要性が確保されています。
臨床性能評価の実施方法
臨床性能評価では、実際の医療現場での使用条件を模擬した評価環境の構築が重要です。
富士フイルム株式会社のEW10-EG01は、上部消化管内視鏡検査時にリアルタイムで胃腫瘍性病変や食道扁平上皮癌の検出を行う機能で2022年9月に承認され、実臨床での有用性を実証しています。
多施設共同研究による臨床データの収集は、AI医療機器の汎用性確保に不可欠です。サイバネットシステム株式会社のEndoBRAINシリーズは、複数の医療機関での臨床評価を通じて、内視鏡画像診断支援における高い実用性を示し、2018年から2020年にかけて4製品の承認を取得しました。


ソフトウェア検証とAI性能評価の統合
ソフトウェア検証とAI性能評価の統合では、従来のソフトウェアテストにAI特有の評価項目を追加する必要があります。エルピクセル株式会社のEIRL Brain Aneurysm、EIRL Brain Metry、EIRL Brain Segmentationなどの既存製品群は、包括的な脳画像診断支援を提供し、統合的な性能評価の成功例となっています。
自動静的解析ツールの活用は、AI医療機器のソフトウェア品質向上に効果的です。MathWorksのMATLABとSimulinkは、IEC 82304やIEC 62304などの業界規格に準拠したSaMDアプリケーション開発をサポートし、検証と妥当性確認の自動化を可能にしています。



設計フェーズでの「要求→実装→検証」の一貫管理が、AI医療機器の長期的品質保証に直結します。
AI医療機器の薬事承認とIEC 82304適合性の証明
PMDA審査におけるIEC 82304の位置づけ
PMDA審査では、IEC 82304-1への適合性がAI医療機器の安全性評価において重要な要素となっています。PMDAが2023年に公表した「AIを活用したプログラム医療機器に関する報告書」では、AI医療機器特有のリスクマネジメントとして、データバイアスの管理、継続的学習機能への対応、アルゴリズムの透明性確保が重視されています。
エルピクセル株式会社は、これらの要求事項に対応した開発プロセスを確立し、9製品の薬事承認を取得することで、PMDA審査における実践的な対応方法を示しています。
審査プロセスでは、Total Product Life Cycle(TPLC)アプローチが採用され、市販前の評価だけでなく市販後の継続的な監視体制が評価されます。FDAの事前変更管理計画に相当する国内制度として、IDATENによる変更申請プロセスが確立されており、AI医療機器の性能変化に対する管理体制が整備されています。
- Total Product Life Cycle(TPLC)アプローチの採用
- 市販前評価と市販後監視体制の統合評価
- IDATENによる変更申請プロセスの活用
- AI特有のリスクマネジメント体制の確認
薬事申請資料でのIEC 82304適合性の示し方
薬事申請資料では、IEC 82304-1の各要求事項に対する適合性を体系的に示す必要があります。株式会社MDAコンサルティングが提供する設計開発手順書では、ISO 13485、ISO 14971、IEC 62366-1、IEC 81001-5-1との連携を重視した文書化プロセスが示されています。
富士フイルム株式会社の複数のAI医療機器承認事例では、リスクマネジメントファイル、ソフトウェア設計仕様書、検証・妥当性確認報告書において、IEC 82304-1への適合性が明確に記載されています。
申請資料の作成では、AI特有の要素として事前仕様(SPS:SaMD Pre-Specifications)とアルゴリズム変更プロトコール(ACP:Algorithm Change Protocol)の記載が重要です。これらの文書は、AI医療機器の継続的な学習機能と性能変化への対応方針を明確化し、規制当局による評価の基準となります。


SaMD開発ガイダンスとの関連性
PMDAが公表した「医療機器プログラム(SaMD)開発ガイダンス」は、IEC 82304-1と密接に関連しており、AI医療機器開発における実践的な指針を提供しています。ガイダンスでは、SaMDのリスク分類に基づく開発プロセスの調整、継続的な学習機能を持つAI医療機器の管理方法、市販後監視体制の確立が詳細に説明されています。
国立医薬品食品衛生研究所の報告書によると、AI/ML利用医療機器に対応するためには、IEC 62304とIEC 82304の改訂が必要であり、具体的な改訂内容も提言されています。この動向は、AI医療機器開発における規格の継続的な進化と、開発者による最新情報の把握の重要性を示しています。
医用画像診断支援システム開発ガイドラインとの整合
経済産業省が公表した「医用画像診断支援システム開発ガイドライン」では、AI技術を利用するCAD(Computer-Aided Detection/Diagnosis)システムの開発において、JIS T 82304(IEC 82304-1の日本版)の適用が明確に規定されています。ガイドラインでは、専用ハードウェアと組み合わせて出荷されるCADソフトウェアの場合はJIS T 0601-1が適用され、単体ソフトウェアの場合はJIS T 82304が適用されることが明記されています。
CADシステムの安全クラス分類では、診断支援の性質を考慮してクラスBに相当するとされており、これに応じたJIS T 2304の設計開発プロセスの実行が要求されています。AI技術を用いるCADの場合、学習データと学習済みモデルをSOUP(Software of Unknown Provenance)アイテムとして扱い、適切な管理プロセスを確立することが重要です。
AI利活用プログラム医療機器の評価指標
PMDAの「AI利活用プログラム医療機器の評価指標」では、AI医療機器の品質、有効性、安全性を確保するための具体的な評価項目が示されています。評価指標では、学習データの品質管理、アルゴリズムの透明性、継続的な性能監視、サイバーセキュリティ対策などが重視されており、これらの項目はIEC 82304-1の要求事項と密接に関連しています。
評価プロセスでは、AI医療機器の検出・診断の原理、学習プロセス、情報セキュリティに関する基本的事項の明確化が求められます。併用する画像撮影装置等の条件、ソフトウェア実行環境の明確化、解析対象病変の特徴と特徴量の明示など、詳細な技術仕様の文書化が必要です。
- 学習データの品質管理体制の確立
- アルゴリズムの透明性と説明可能性の確保
- 継続的な性能監視システムの構築
- IEC 81001-5-1に基づくサイバーセキュリティ対策



SPS・ACPの文書化は、継続学習型AIの規制対応と開発スピードの両立を支える実務的要素です。
画像診断支援AI開発の成功事例とIEC 82304対応
国内承認済みAI医療機器の開発事例分析
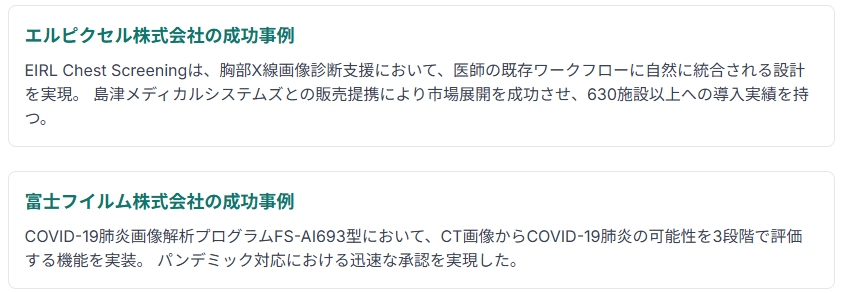

国内で承認されたAI医療機器の開発事例を分析すると、IEC 82304-1への体系的な対応が成功の鍵となっています。
エルピクセル株式会社のEIRL Chest Screeningは、胸部X線画像診断支援において、医師の既存ワークフローに自然に統合される設計を実現し、島津メディカルシステムズとの販売提携により市場展開を成功させました。同社は630施設以上への導入実績を持ち、AI医療機器の実用化における最も成功した事例の一つとなっています。
富士フイルム株式会社は、COVID-19肺炎画像解析プログラムFS-AI693型において、CT画像からCOVID-19肺炎の可能性を3段階で評価する機能を実装し、パンデミック対応における迅速な承認を実現しました。この成功は、事前に確立されたIEC 82304-1準拠の開発プロセスと、緊急時における柔軟な対応体制によるものです。


主たる機能をAIの活用により開発された医療機器の特徴
PMDAの報告書によると、「主たる機能をAIの活用により開発されていることを明らかにして承認されたプログラム医療機器」は、AI技術が医療機器の中核機能を担う製品として定義されています。
岡山大学と両備システムズの早期胃癌深達度AI診断支援システムは、この定義に該当する代表的な事例であり、82%の正診率を実現して従来の専門医による72%を上回る性能を示しています。
これらの医療機器の特徴は、機械学習アルゴリズムが診断支援の主要な機能を担い、継続的な学習機能を通じて性能向上を図ることです。アイリス株式会社のnodoca(ノドカ)は、咽頭画像と体温等を解析してインフルエンザの特徴的所見を検出する新医療機器として2022年4月に承認され、AI医療機器の新たな分野を開拓しました。


海外AI医療機器のIEC 82304対応事例
海外のAI医療機器開発においても、IEC 82304-1への準拠は重要な要件となっています。FDAの事前変更管理計画(Predetermined Change Control Plan)では、AI/ML対応医療機器の機能変更に対する体系的な管理手法が確立されており、SPS(SaMD Pre-Specifications)とACP(Algorithm Change Protocol)を含む変更管理計画の作成が推奨されています。
欧州のMDR(Medical Device Regulation)においても、AI医療機器のサイバーセキュリティとソフトウェア安全性に関する要求事項が強化されており、IEC 82304-1とIEC 81001-5-1への適合が実質的に必要となっています。これらの国際的な動向は、日本国内のAI医療機器開発における規制対応の参考となります。
- FDAの事前変更管理計画による体系的な変更管理
- 欧州MDRによるサイバーセキュリティ要求事項の強化
- 国際規格への適合による市場アクセスの確保
- 市販後監視体制の国際的な標準化



海外ではSPS/ACPに基づく変更管理が標準化されつつあり、日本でもIDATENとの整合が実務的に重要になります。
AI医療機器開発の効率化とIEC 82304対応の最適化
アジャイル開発手法とIEC 82304の親和性
AI医療機器開発では、アジャイル開発手法とIEC 82304-1の要求事項を両立させることが重要です。MathWorksのMATLABとSimulinkは、IEC 82304やIEC 62304などの業界規格に準拠したSaMDアプリケーション開発をサポートし、反復的な開発プロセスにおける品質保証を可能にしています。
エルピクセル株式会社は、EIRL AI パートナープログラムを通じて、アジャイル開発手法を活用した効率的な製品開発プロセスを確立しています。
アジャイル開発では、短いスプリント期間での継続的な検証・妥当性確認が必要となります。株式会社MDAコンサルティングの設計開発手順書では、テストスクリプト、テストデータ、テストログの体系的な管理手法が示されており、アジャイル環境での品質保証に有効です。
継続的インテグレーションとAI品質管理
AI医療機器開発における継続的インテグレーション(CI)では、機械学習モデルの性能監視と品質管理の自動化が重要です。
gMendel社は、IEC 62304準拠のソフトウェア開発ライフサイクルにCI/CDパイプラインを統合し、遺伝性疾患診断支援システムの開発効率を大幅に向上させました。自動静的解析ツールの活用により、コード品質の継続的な監視と改善が可能になります。
品質管理プロセスでは、学習データの品質、モデルの性能、セキュリティ脆弱性の継続的な評価が必要です。PMDAの報告書では、AI医療機器の市販後監視において、Real-World Performance(実際の性能)による継続的な検証の重要性が強調されています。
クラウド環境でのIEC 82304準拠開発
クラウド環境でのAI医療機器開発では、IEC 81001-5-1:2021のサイバーセキュリティ要求事項への対応が重要です。IBM Engineering Lifecycle Managementソリューションは、医療機器業界向けに設計されたデジタル変革プラットフォームを提供し、クラウドベースでのIEC 82304準拠開発を支援しています。
クラウド開発では、データの暗号化、アクセス制御、監査ログの管理など、包括的なセキュリティ対策が必要です。厚生労働省の基本要件基準改正により、サイバーセキュリティに関する要求事項が追加され、クラウド環境での開発においてもこれらの要件への適合が必須となっています。



クラウド開発環境では、IEC 81001-5-1に基づくセキュリティ設計の初期組み込みが安全性担保の前提になります。
将来展望:AI医療機器開発とIEC 82304の進化
新たなAI技術とIEC 82304対応の課題
AI技術の急速な進歩により、IEC 82304-1の要求事項も継続的な見直しが必要となっています。国立医薬品食品衛生研究所の報告書では、AI/ML利用医療機器に対応するため、IEC 62304とIEC 82304の改訂が必要であり、具体的な改訂内容も提言されています。特に機械学習を活用した異常検知システムの導入により、製造工程の数百のパラメータをリアルタイムで監視し、従来の管理図では検出困難な複合的な異常パターンを検出できるようになっています。
FDAが提案するGMLP(Good Machine Learning Practice)は、AI医療機器開発企業の製品ライフサイクル全体を運営・管理する能力の施設基準として注目されています。
これは医薬品製造のGMP(Good Manufacturing Practice)や市販後モニターのGVP(Good Vigilance Practice)のAI医療機器版に相当し、将来的にAI医療機器開発企業の必須要件となる可能性があります。


国際規格の動向とSNAIGの取り組み
国際医療機器規制国際整合化会議(IMDRF)では、AI医療機器の規制枠組みに関する議論が継続的に行われています。従来のGHTF(Global Harmonization Task Force)から発展的に解散して現在のIMDRFとなり、世界各国の規制当局が集まって医療機器の安全基準を統一する取り組みが進められています。
日本でも国際整合を踏まえて基本要件基準が厚生労働省の告示として出され、IEC 82304-1への適合性が薬事承認の必須要件となっています。
PMDAが設置した科学委員会AI専門部会は、2017年12月に「AIを活用した医療診断システム・医療機器等に関する課題と提言2017」をとりまとめ、レギュラトリーサイエンスの観点からAIを医療機器へ適用する際の課題を整理しました。この取り組みは世界に先がけて進められており、その概要が国際ジャーナル『Advanced Biomedical Engineering』に掲載されるなど、国際的な注目を集めています。
- IMDRF(国際医療機器規制国際整合化会議)による規制統一
- 基本要件基準の国際整合化とエッセンシャルリクワイアメント
- PMDAのAI専門部会による先進的な取り組み
- レギュラトリーサイエンスの国際的な発信
次世代AI医療機器開発への提言
次世代AI医療機器開発では、継続的な学習機能と性能変化への対応が重要な課題となります。PMDAの「AIを活用したプログラム医療機器に関する報告書」では、Total Product Life Cycle(TPLC)アプローチが採用され、市販前の評価だけでなく市販後の継続的な監視体制が評価されています。
IDATEN(医療機器変更計画確認申請制度)を利用した迅速な変更申請プロセスにより、AI医療機器の性能変化に対する管理体制が整備されています。
リアルワールドデータ(RWD)の活用により、AI医療機器の実際の性能監視と改善が可能になります。テキストマイニングによる不具合報告からのパターン抽出、統計的手法を用いた微小傾向の早期検出、予測モデルの構築によるリスク予測など、データ解析技術の高度化が進んでいます。これらの技術革新により、IEC 82304-1の要求事項をより効果的に満たすことが可能となります。





AI医療機器の進化に伴い、IEC 82304-1の「静的な要求事項」から「動的な性能監視」を前提とした設計基準への移行が求められています。
IEC 82304開発×AIに関してよくある質問
IEC 82304-1はすべてのAI医療機器に適用されますか?
IEC 82304-1は、単体で動作するヘルスソフトウェアに適用される規格であり、AI医療機器がSaMD(Software as a Medical Device)として分類される場合は適用対象となります。
経済産業省の「医用画像診断支援システム開発ガイドライン」では、AI技術を利用するCADシステムの開発において、JIS T 82304(IEC 82304-1の日本版)の適用が明確に規定されています。ただし、医療機器に組み込まれたソフトウェアについては、IEC 62304との併用が必要です。
基本要件基準への適合性は、クラス1からクラス4まですべての医療機器で必須であり、IEC 82304-1を満たさない医療機器は申請できません。PMDAの審査では、基本要件基準への適合性に関する資料の提出が義務付けられており、適合性チェックリストの作成が必要です。
AI特有のリスクはIEC 82304でどのように管理しますか?
AI特有のリスクには、学習データのバイアス、アルゴリズムの予期せぬ挙動、継続学習による性能変化などがあります。
IEC 82304-1では、ISO 14971に基づくリスクマネジメントプロセスの確立が要求されており、AI特有のリスクに対しても体系的な管理が必要です。PMDAの報告書では、データバイアスの管理、継続的学習機能への対応、アルゴリズムの透明性確保が重視されています。
リスク管理では、ハザード分析とFMEA(故障モード影響解析)を組み合わせた手法が有効です。機械学習モデルの継続的な性能監視には、ドリフト検出とモデル再学習の自動化が不可欠であり、Real-World Performance(実際の性能)による継続的な検証が重要となります。
薬事申請でIEC 82304適合性はどう証明しますか?
薬事申請では、IEC 82304-1の各要求事項に対する適合性を基本要件適合性チェックリストで体系的に示す必要があります。
申請資料には、リスクマネジメントファイル、ソフトウェア設計仕様書、検証・妥当性確認報告書において、IEC 82304-1への適合性を明確に記載することが求められます。AI医療機器特有の要素として、事前仕様(SPS:SaMD Pre-Specifications)とアルゴリズム変更プロトコール(ACP:Algorithm Change Protocol)の記載が重要です。
基本要件基準の第12条「プログラムを用いた医療機器に対する配慮」では、IEC 62304:2006とIEC 81001-5-1(サイバーセキュリティ)への準拠が要求されており、これらの規格への適合性も併せて証明する必要があります。
継続学習するAIはIEC 82304にどう対応しますか?
継続学習機能を持つAI医療機器では、市販後の性能変化に対する管理体制の確立が重要です。FDAが推奨する事前変更管理計画(Predetermined Change Control Plan)では、SPS(SaMD Pre-Specifications)とACP(Algorithm Change Protocol)を含む変更管理計画の作成が推奨されています。
日本では、IDATEN(医療機器変更計画確認申請制度)を利用した迅速な変更申請プロセスが確立されており、継続学習による性能変化への対応が可能です。
継続学習機能の管理では、学習データの品質管理、アルゴリズムの透明性確保、継続的な性能監視が必要です。市販後監視活動の一環として、サイバーセキュリティ脆弱性の継続的モニタリングも求められており、IEC 81001-5-1への準拠が重要となります。
IEC 82304とISO 14971の関係性は?
IEC 82304-1とISO 14971は密接に関連しており、AI医療機器開発では両規格への適合が必要です。
IEC 82304-1の第2条「リスクマネジメント」では、ISO 14971に基づく体系的なリスクマネジメントプロセスの確立が要求されています。基本要件基準では、「最新の技術(State of the Art)に立脚して医療機器の安全性を確保しなければならない」と規定されており、危険性の識別、評価、除去または軽減の手順が必要です。
AI医療機器では、従来の医療機器リスクに加えて、機械学習特有のリスクへの対応が求められます。リスク評価プロセスでは、AI特有の脅威モデリングを統合し、継続的な学習機能による性能変化に対するリスク管理体制を確立することが重要です。


