ISO 13485とAI医療機器開発|品質マネジメントシステムの要求事項と実装方法

「ISO 13485とAI医療機器開発って何?」「AI技術を使った医療機器の品質管理はどうすればいいの?」「開発プロセスで注意すべきポイントは?」そう思う方も多いのではないでしょうか。
実は、AI医療機器開発においてISO 13485の品質マネジメントシステムを適切に実装することで、製品の安全性と有効性を確保しながら、グローバル市場での競争優位性を獲得することが可能です。株式会社AIメディカルサービスやアナウト株式会社など、実際にISO 13485認証を取得してAI医療機器の開発に成功している企業事例も数多く存在します。
本記事では、ISO 13485の基本概念から、AI医療機器開発における具体的な適用方法、実装事例、規制対応のメリット、そして将来性まで、品質マネジメントシステムの構築に必要な情報を詳しく解説していきます。AI技術を活用した医療機器開発を成功させるための実践的なガイドとして、ぜひ最後までお読みください。
- ISO 13485の基本内容とISO 9001との違い、AI医療機器開発における重要性
- AI医療機器開発でのISO 13485要求事項の具体的な適用方法と実装プロセス
- AIメディカルサービスやアナウト株式会社など実際のISO 13485認証取得事例と成功要因
- プログラム医療機器の薬事承認におけるISO 13485認証のメリットと必要性
- AI医療機器開発の将来性とグローバル展開における品質マネジメントの役割
ISO 13485とAI医療機器開発における品質マネジメントの基礎知識
ISO 13485の基本概念と医療機器開発での役割
ISO 13485は、医療機器の安全性と有効性および品質の維持を目的とした国際規格です。
この規格は医療機器の設計・開発・製造・販売等に携わる組織を対象とし、医療機器メーカーが安定した医療機器及び関連サービスの提供を保証することを目的としています。AI医療機器開発においても、この規格は製品の信頼性確保と市場参入の必須要件となっています。
医療機器に特化した品質マネジメントシステムの特徴
ISO 13485は一般的な品質マネジメントシステムとは異なり、医療機器特有のリスク管理要件を含んでいます。特にAI医療機器では、アルゴリズムの透明性、データの品質管理、継続的な学習による変更管理など、従来の医療機器にはない新たな課題への対応が求められます。
- アルゴリズムの透明性確保
- 学習データの品質管理
- 継続的学習による変更管理
- サイバーセキュリティ対策
株式会社AIメディカルサービスでは、胃がん診断支援AIの開発において、100以上の共同研究機関から提供された大量の内視鏡動画データを教師データとして活用し、ISO 13485認証に基づく厳格な品質管理体制を構築しています。
AI技術導入による医療機器開発の変化
AI技術の導入により、医療機器開発のプロセスは大きく変化しました。従来の静的な医療機器とは異なり、AI医療機器は継続的な学習と改善が可能です。
しかし、この特性により品質管理の複雑さも増しており、ISO 13485の要求事項をAI特有の課題に適応させる必要があります。
ISO 9001とISO 13485の違いと医療機器開発での重要性
規制要件への対応における相違点
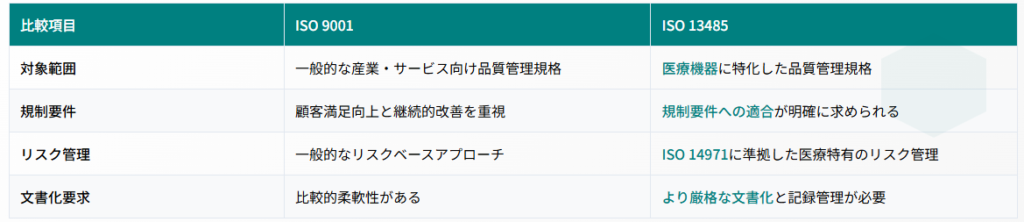
ISO 9001が一般的な品質マネジメントシステムであるのに対し、ISO 13485は医療機器に特化した規格です。最も重要な違いは、ISO 13485では規制要件への適合が明確に求められている点です。
AI医療機器の場合、薬機法やFDA規制、CEマーキングなど、各国の医療機器規制への適合が必要となります。
アナウト株式会社では、手術支援ソフトウェア「Eureka α」の開発において、2025年3月17日にISO 13485を取得し、米国FDAおよび欧州CEマークの取得に向けた準備を進めています。
リスクマネジメントの強化要件
ISO 13485では、ISO 14971(医療機器のリスクマネジメント)との整合性が重視されます。AI医療機器では、誤診断のリスク、データプライバシーのリスク、サイバーセキュリティリスクなど、従来の医療機器にはない新たなリスク要因への対応が必要です。
これらのリスクを適切に管理するため、より厳格なリスクマネジメントプロセスの構築が求められています。
 ReAlice株式会社 開発担当者
ReAlice株式会社 開発担当者AIの特性に対応するには、データ起点の品質設計や変更管理の設計段階からの織り込みが不可欠です。
AI医療機器開発でのISO 13485要求事項と具体的な適用方法
AIアルゴリズム開発における設計・開発管理
学習データの品質管理と文書化要件
AI医療機器開発では、学習データの品質が製品の性能に直接影響します。ISO 13485の文書化要件に従い、データの収集方法、前処理プロセス、品質評価基準を明確に定義する必要があります。


株式会社AIメディカルサービスでは、140施設以上の医療機関と共同研究を行い、世界トップクラスの医療機関から提供された教師データを基にAI開発を進めています。同社の胃がん診断支援AIは厚生労働大臣から製造販売承認を取得しています。
AIモデルのバリデーションとバージョン管理
AI医療機器では、モデルの継続的な改善が可能である一方、各バージョンの性能検証と変更管理が重要になります。
ISO 13485では、設計変更に対する厳格な管理が求められており、AIモデルの更新時には再バリデーションプロセスを確立する必要があります。これにより、製品の安全性と有効性を継続的に保証できます。
AI特有のリスクマネジメントと安全性確保


アルゴリズムの透明性と説明可能性の要求
AI医療機器では、診断や治療支援の根拠を医師が理解できることが重要です。ブラックボックス化したアルゴリズムではなく、医師が判断根拠を確認できる説明可能なAIの開発が求められています。
AI医療機器開発においては、性能、安全性、品質管理とともに透明性の確保が重要な要素として位置づけられています。
サイバーセキュリティとデータプライバシー対策
AI医療機器はネットワーク接続が前提となることが多く、サイバーセキュリティ対策が不可欠です。ISO 13485の要求事項に加えて、医療情報の保護に関する法規制への適合も必要となります。
エルピクセル株式会社では、AI画像診断支援技術「EIRL」の開発において、2021年2月17日にISO 13485:2016の認証を取得し、高い信頼性と安全性を確保しています。



モデル更新時の再評価体制や説明可能性の担保は、単なる技術論でなく臨床現場との信頼形成の基盤でもあります。サイバーリスクへの対応も含め、技術と法規制を跨いだ運用設計が求められます。
AI医療機器開発における品質マネジメントシステムの実装事例
内視鏡AI診断支援システムの開発事例


AIメディカルサービスのISO 13485取得プロセス
株式会社AIメディカルサービスは、2022年12月6日にISO 13485を取得し、グローバル展開への基盤を構築しました。
同社は「世界の患者を救う〜内視鏡AIでがん見逃しゼロへ〜」をミッションに掲げ、胃がん診断支援AIの研究開発に取り組んでいます。取得の背景として、欧米など一部の国やエリアへの事業展開では同認証の取得が必須となっている地域があることが挙げられます。
2022年1月にシリコンバレー、同年7月にシンガポール、2023年1月にニューヨークに拠点を設立し、グローバル展開を加速。
医療機器という人の命にかかわる事業として、自社基準での厳格な管理体制を確立。
世界トップクラスの認証機関であるテュフズード(TÜV SÜD)からISO 13485認証を取得。
胃がん診断支援AIの品質管理体制
同社の胃がん診断支援AIは、がん研有明病院、大阪国際がんセンター、東京大学病院をはじめとする140施設以上の医療機関との共同研究により開発されています。
AI技術開発では、世界トップクラスの医療機関から提供された大量の内視鏡動画データを教師データとして活用し、厚生労働大臣から製造販売承認を取得するなどの成果を上げています。
- 協力医療機関:140施設以上
- AI教師データ:世界トップクラスの医療機関提供データ
- 製品承認:厚生労働大臣製造販売承認取得済み
この体系的なアプローチにより、世界トップクラスの第三者認証機関であるテュフズード(TÜV SÜD)からISO 13485認証を取得しました。
手術支援AIソフトウェアの開発事例

アナウト株式会社の品質マネジメント実装
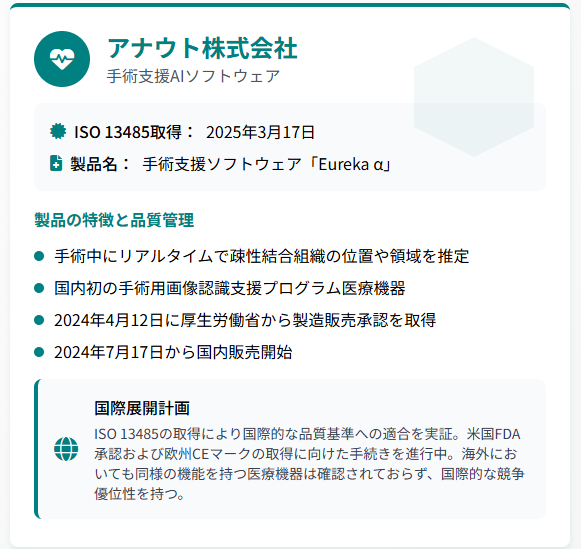
アナウト株式会社は、2025年3月17日にISO 13485を取得し、手術支援ソフトウェア「Eureka α」の国際展開を加速させています。
同社が開発した手術用画像認識支援プログラム「Eureka α」は、手術中にリアルタイムで疎性結合組織の位置や領域を推定し、医師に視覚的な支援を提供する医療機器です。この技術は、手術動画を解析し解剖学的構造物の位置や領域を推定することができる国内初のプログラム医療機器として注目されています。
リアルタイム画像認識AIの安全性確保
「Eureka α」は2024年4月12日に厚生労働省から製造販売承認を受け、同年7月17日から国内での販売を開始しています。この製品は体内の微細な解剖を精密に描写し、外科医を術中支援するものであり、海外においても同様の機能を持つ医療機器は確認されていません。
アナウト株式会社では、米国FDAおよび欧州CEマークの取得に向けた手続きを進めており、ISO 13485の取得により国際的な品質基準への適合を実証しています。
- 国内初の手術用画像認識支援プログラム医療機器
- リアルタイムでの解剖学的構造物の位置推定
- 厚生労働省製造販売承認取得済み
- 米国FDA・欧州CEマーク取得準備中



国際認証を取得した2社の事例は、AI医療機器の信頼性を担保するには技術力だけでなく、品質管理の構造設計が不可欠であることを示しています。国内外の医療現場と連携した実証、データの厳密な管理、そして第三者視点での検証を通じて、製品の社会実装に耐えうる体制が築かれています。
AI医療機器開発での規制対応とISO 13485認証のメリット
薬機法とISO 13485の関係性

プログラム医療機器の承認審査における重要性
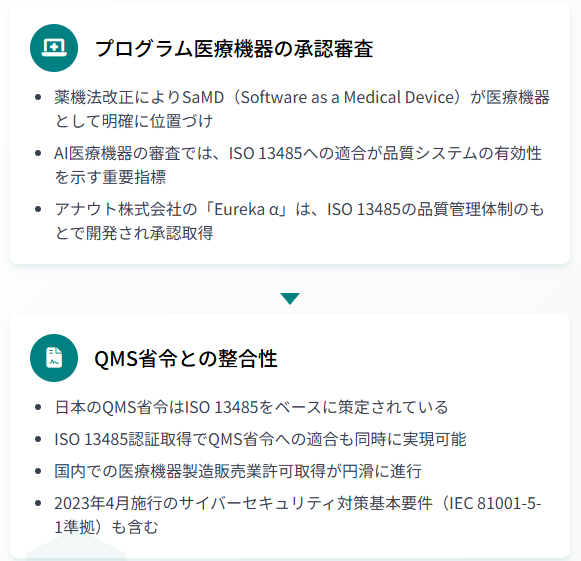
日本では薬機法の改正により、プログラム医療機器(SaMD:Software as a Medical Device)が明確に医療機器として位置づけられました。AI医療機器の承認審査では、ISO 13485への適合が品質マネジメントシステムの有効性を示す重要な指標となります。
アナウト株式会社の「Eureka α」は、ISO 13485の品質管理体制のもとで開発され、厚生労働省の承認を取得した成功事例です。
QMS省令との整合性確保
日本のQMS省令(医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令)は、ISO 13485をベースに策定されています。
ISO 13485認証を取得することで、QMS省令への適合も同時に実現でき、国内での医療機器製造販売業許可取得が円滑に進みます。これにより、AI医療機器メーカーは効率的に規制要件をクリアできます。
グローバル展開におけるISO 13485認証の価値
海外市場参入での競争優位性
ISO 13485認証は、グローバル市場での信頼性確保に不可欠です。株式会社AIメディカルサービスでは、2022年1月にシリコンバレー、同年7月にシンガポール、2023年1月にニューヨークに拠点を設立し、海外展開を加速させています。
ISO 13485認証により、これらの地域での事業展開において国際標準規格に適合した開発体制を証明できています。
- 2022年1月:シリコンバレーに米国法人設立
- 2022年7月:シンガポールに現地法人設立
- 2023年1月:ニューヨークに米国第2号拠点開設
- シンガポール国立大学病院と共同研究契約締結
国際的な信頼性向上とブランド価値
ISO 13485認証は、医療機器メーカーとしての国際的な信頼性を大幅に向上させます。
エルピクセル株式会社では、AI画像診断支援技術「EIRL」において、TÜV Rheinlandから認証を取得し、医療診断画像の解析に使用するソフトウェアの設計と開発と配布における品質管理体制を国際的に認められています。この認証により、同社は医療機器製品の開発を通じて医療の発展に貢献する体制を確立しています。
特に欧米など一部の国やエリアへの事業展開では、ISO 13485認証の取得が必須となっている地域もあり、グローバル展開を本格化させるための重要な要件となっています。



国内QMS省令との親和性を活かしつつ、海外規制との整合性を早期に押さえることが、開発から商業化への移行をスムーズにします。
AI医療機器開発の効率化とISO 13485による業務プロセス最適化
品質マネジメントシステム導入による開発効率向上
文書化プロセスの標準化とトレーサビリティ確保
ISO 13485の導入により、AI医療機器開発における文書化プロセスが標準化され、開発効率が大幅に向上します。設計仕様書、テスト結果、変更履歴などの文書管理が体系化されることで、開発チーム間の情報共有が円滑になり、プロジェクトの進行速度が向上します。
- 設計仕様書の標準化による開発効率向上
- テスト結果の体系的管理
- 変更履歴の完全なトレーサビリティ
- 開発チーム間の円滑な情報共有
株式会社AIメディカルサービスでは、100施設以上との共同研究において、統一された文書管理システムにより効率的なデータ収集と品質管理を実現しています。
継続的改善による開発サイクルの短縮
ISO 13485の継続的改善要求により、AI医療機器の開発サイクルが短縮されます。定期的な内部監査と是正処置により、開発プロセスの問題点が早期に発見され、迅速な改善が可能になります。
これにより、市場投入までの期間短縮と品質向上を同時に実現できます。
AI開発チームの組織体制強化
人材育成と力量管理の重要性
AI医療機器開発では、医学知識とAI技術の両方に精通した人材が必要です。ISO 13485では、従業員の力量管理と教育訓練が重視されており、体系的な人材育成プログラムの構築が求められます。
アナウト株式会社では、手術支援AI開発において、外科医とAIエンジニアの協働体制を構築し、専門性の高い製品開発を実現しています。

多職種連携による品質向上
AI医療機器開発では、医師、エンジニア、薬事担当者、品質管理担当者など多職種の連携が不可欠です。ISO 13485の組織要求により、各職種の役割と責任が明確化され、効果的なチームワークが実現されます。
これにより、医療現場のニーズを的確に反映した高品質なAI医療機器の開発が可能になります。




AI医療機器開発においては、QMSの導入が単なる文書管理の枠を超え、組織全体の開発力そのものを底上げします。標準化された運用は属人性を排除し、継続的改善の文化が機動力と品質を両立させます。
AI医療機器開発における将来性とISO 13485の進化
AI技術の進歩と品質マネジメントの対応
機械学習モデルの継続的更新への対応
AI医療機器の特徴である継続的学習機能に対応するため、ISO 13485の要求事項も進化が必要です。
従来の静的な医療機器とは異なり、AI医療機器では運用中のモデル更新が可能であり、これに対応した変更管理プロセスの確立が重要になります。株式会社AIメディカルサービスの内視鏡AIでは、継続的なデータ収集により、診断精度の向上を図っています。
- 運用中のモデル更新に対する変更管理
- 継続的学習による性能変化の監視
- レガシー医療機器のサイバーセキュリティ対応
- ソフトウェア部品表(SBOM)の管理
特に重要なのは、2023年4月1日から施行されたサイバーセキュリティ対策の基本要件基準第12条「プログラムを用いた医療機器に対する配慮」への対応です。
これにより、プログラムを使用した医療機器を製造販売する企業はサイバーセキュリティ対策が必須となり、IEC 81001-5-1:2021への準拠が求められています。
新たなAI技術への規格適用
深層学習、強化学習、生成AIなど、新たなAI技術の医療機器への応用が進む中、ISO 13485もこれらの技術に対応した要求事項の整備が進められています。将来的には、AI特有のリスク評価手法や検証方法が規格に組み込まれることが予想されます。
メドメイン株式会社では、2025年2月19日にISO 13485認証を取得し、デジタル病理支援AI搭載クラウドシステム「PidPort」の国際展開に向けた体制を強化しています。
医療DXとISO 13485の役割
デジタルヘルスケア市場での競争力強化
医療DXの進展により、AI医療機器の市場は急速に拡大しています。ISO 13485認証は、この成長市場において競争優位性を確保するための重要な要素となります。
エルピクセル株式会社では、AI画像診断支援技術「EIRL」により、脳MRI、胸部X線などの医療画像情報を解析し、効率的で正確な診断環境の提供を目指しています。
- 画像診断AIによる読影時間の削減
- 異常所見の自動抽出と病変識別
- 疾患名候補の提示とレポーティング支援
- マルチモーダルAIによる総合的診断支援
NTTデータが開発した脳MRI診断支援AI技術について、エルピクセルが医療機器品質マネジメントシステムに対応した製品開発と薬事戦略の立案から性能評価まで一貫して支援しており、AI技術の実用化における品質管理の重要性が示されています。
患者安全性向上への貢献
AI医療機器の普及により、診断精度の向上と医師の負担軽減が実現されています。
株式会社AIメディカルサービスの胃がん診断支援AIでは、医師の見落としを防止し、6mm以上の胃がん検出率約98%を達成しています。ISO 13485の品質管理体制により、このような高い性能と安全性を継続的に維持することが可能になっています。
AI医療機器により、従来の診断方法では見落とされがちな病変の早期発見が可能になり、患者の予後改善に大きく貢献しています。
読影業務の自動化により、放射線科医の慢性的な人手不足問題の解決に寄与し、医療現場の働き方改革を推進しています。
早期診断による治療期間の短縮と、効率的な診断プロセスにより、医療費の削減効果が期待されています。



継続学習や生成系AIのような動的技術を扱うには、QMSも静的な枠組みに留まらず、変更管理や性能追跡の設計が求められます。さらに、サイバーセキュリティ要件やSBOM対応も含めた包括的運用が前提です。
ISO 13485とAI医療機器開発に関してよくある質問
ISO 13485の内容と医療機器開発での適用範囲は?
ISO 13485は、医療機器の安全性と有効性および品質の維持を目的とした国際規格で、医療機器の設計・開発・製造・販売等に携わる組織を対象としています。
AI医療機器開発では、アルゴリズムの設計から臨床評価、市販後監視まで、製品ライフサイクル全体にわたって適用されます。
特にプログラム医療機器(SaMD)では、ソフトウェア特有の要求事項への対応が重要になります。また、2023年4月からはサイバーセキュリティ対策も基本要件として追加され、IEC 81001-5-1:2021への準拠が必須となっています。
AI医療機器開発でISO 9001とISO 13485の違いは何ですか?
ISO 9001が一般的な品質マネジメントシステムであるのに対し、ISO 13485は医療機器に特化した規格です。
最も重要な違いは、ISO 13485では医療機器規制への適合が明確に求められている点です。AI医療機器では、薬機法、FDA規制、CEマーキングなど各国の規制要件への適合が必要であり、ISO 13485がその基盤となります。
また、リスクマネジメント(ISO 14971)との整合性も重視され、AI特有のサイバーセキュリティリスクへの対応も含まれます。
ISO 13485認証取得のプロセスと期間はどのくらいですか?
ISO 13485認証取得には通常6ヶ月から1年程度の期間が必要です。
株式会社AIメディカルサービスでは、2022年12月6日に認証を取得し、世界トップクラスの第三者認証機関であるテュフズード(TÜV SÜD)から認証を受けています。プロセスには、品質マネジメントシステムの構築、文書化、内部監査、認証機関による審査が含まれます。
AI医療機器の場合、データ管理やアルゴリズム検証、サイバーセキュリティ対策など特有の要求事項への対応が必要になります。
AI特有のリスクマネジメントでISO 13485はどう活用できますか?
AI医療機器では、誤診断リスク、データプライバシーリスク、サイバーセキュリティリスクなど従来にない新たなリスクへの対応が必要です。
ISO 13485のリスクマネジメント要求により、これらのリスクを体系的に評価し、適切な対策を講じることができます。アナウト株式会社の「Eureka α」では、手術中のリアルタイム画像認識における安全性確保のため、厳格なリスク管理体制を構築しています。
また、IEC 81001-5-1:2021に準拠したサイバーセキュリティ対策により、ネットワーク接続されたAI医療機器の安全性を確保しています。
プログラム医療機器の薬事承認でISO 13485は必須ですか?
日本では薬事承認において直接的にISO 13485認証が必須要件ではありませんが、QMS省令への適合が求められており、ISO 13485はその有効な手段となります。
アナウト株式会社の「Eureka α」は、ISO 13485の品質管理体制のもとで開発され、2024年4月12日に厚生労働省の製造販売承認を取得しています。海外展開を視野に入れる場合、ISO 13485認証は事実上必須となっており、グローバル市場での競争力確保に不可欠です。
特に欧米など一部の国やエリアへの事業展開では同認証の取得が必須となっている地域もあり、国際的な信頼性確保のために重要な要件となっています。


