JIS T 2304準拠のAI医療機器開発|規制要件から実装まで完全解説

JIS T 2304に準拠したAI医療機器開発は、医療現場のデジタル変革を推進する重要な技術領域として注目を集めています。現在、エルピクセル株式会社やサイバネットシステム株式会社など、先進企業が次々と薬事承認を取得し、AI医療機器市場の急速な拡大を牽引しています。しかし、多くの開発企業が直面するのは、複雑な規制要件への対応と開発効率化の両立という課題です。
本記事では、JIS T 2304に準拠したAI医療機器開発の実践的なアプローチから、学習データ管理、SOUP(Software of Unknown Provenance)の取り扱い、説明可能AI(XAI)の実装まで、承認取得に必要な具体的な要件を詳しく解説します。
さらに、富士フイルム株式会社やBioMindなどの成功事例を通じて、開発期間短縮とコスト削減を実現するベストプラクティスをご紹介します。医療AIプラットフォーム技術研究組合(HAIP)が策定した最新ガイドラインや、PMDAの市販後学習機能に関する最新動向も踏まえ、AI医療機器開発の将来展望まで包括的にカバーしています。
- JIS T 2304に準拠したAI医療機器開発の具体的な要件と実装方法
- エルピクセル・富士フイルムなど成功企業の承認取得戦略と開発プロセス
- 学習データ管理・SOUP取り扱い・説明可能AIなどAI特有の技術的課題の解決法
- 市販後学習機能を持つAI医療機器の規制対応と安全性確保の方法
- 開発期間短縮・コスト削減を実現する効率化戦略と将来の市場展望
JIS T 2304とAI医療機器開発の基礎知識

JIS T 2304(IEC 62304)とは何か
JIS T 2304は、医療機器ソフトウェアのライフサイクルプロセスを定義した国際規格IEC 62304の日本版です。この規格は医療機器ソフトウェアの安全性確保と品質管理において中核的な役割を果たしています。
AI技術を組み込んだ医療機器では、従来のソフトウェア開発プロセスに加えて、機械学習モデルの特性を考慮した追加要件が求められます。規格では、ソフトウェア安全クラス(A、B、C)に応じて必要なプロセスとドキュメントが段階的に定められており、リスクの高いクラスCでは最も厳格な管理が要求されます。
医療機器ソフトウェアライフサイクルプロセスの概要
医療機器ソフトウェア開発は、要求分析から実装、検証まで一連のV字モデルに従って進行します。ソフトウェア要求事項分析では、システム要求仕様書からソフトウェアシステムの要求事項を定義し、客観的に検証可能な基準を持つ要求事項の作成が重要です。
アーキテクチャ設計では、リスクの高いソフトウェアアイテムをデータフロー、プロセッサ、メモリ空間の面から独立させることで、障害発生時の重大な危害を防ぎます。
実装フェーズでは、コーディング規約の設定により可読性と保守性を確保し、検証段階では合否判定基準を明確に定めることが求められます。
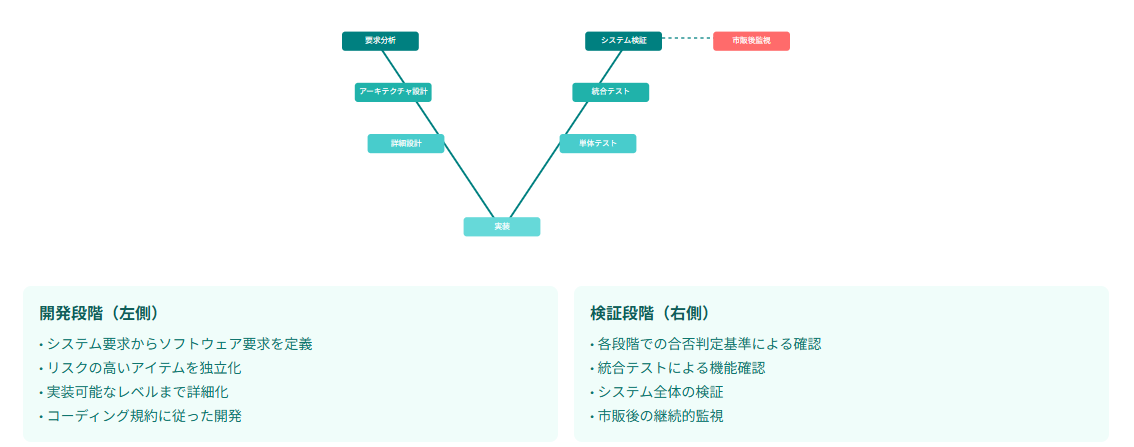
AI医療機器に適用される法的根拠
AI医療機器は、薬機法における「プログラム医療機器」として位置づけられ、PMDAによる薬事承認が必要です。
2018年12月のサイバネットシステム株式会社による内視鏡画像診断支援ソフトウェア「EndoBRAIN」の承認を皮切りに、2024年末時点で複数のAI医療機器が承認されており、承認数は継続的に増加しています。これらの承認事例は、JIS T 2304への適合が国内外の薬事承認において重要な要件であることを示しています。
厚生労働省は「医用画像診断支援システム(人工知能技術を利用するものを含む)開発ガイドライン」を公開し、AI特有の考慮事項を明確化しています。
AI医療機器開発における規制の重要性
従来のソフトウェア開発との違い
AI医療機器では、従来のソフトウェア開発にはない特有の課題があります。機械学習モデルのブラックボックス性により、判断根拠の説明が困難になる場合があります。
エルピクセル株式会社は、ディープラーニングを活用した脳MRI分野の医療機器において、この課題を克服するため十分な性能と裏付ける材料を揃え、時間をかけて承認を取得しました。学習データの品質管理、市販後学習機能、バリデーション方法など、AI特有の要素が開発プロセス全体に影響を与えます。
SOUP(Software of Unknown Provenance)としての学習済みモデルの取り扱いも、従来のソフトウェア開発では考慮されなかった新たな要件です。

薬事承認への影響
JIS T 2304への適合は、薬事承認取得の必須要件となっています。富士フイルム株式会社は、CT画像解析による肺結節検出プログラム「FS-AI688型」で2020年5月に承認を取得し、その後も複数のAI医療機器の承認を重ねています。承認取得には数億円以上の資金と長期間が必要であり、学会・大学・企業の協力体制構築が重要です。
サイバーセキュリティ規格(JIS T 81001-5-1)やSBOM(ソフトウェア部品表)への対応も、薬事承認において考慮すべき要素として重要性が高まっています。承認取得後の市販後調査や継続的な性能監視も、AI医療機器特有の要件として求められます。
 ReAlice株式会社 開発担当者
ReAlice株式会社 開発担当者AI固有のブラックボックス性は、従来のV字モデルにはなかった説明責任と再現性の課題をもたらしており、開発全体の構造に影響を与えます。
AI医療機器開発でJIS T 2304が求める具体的要件
ソフトウェア安全クラス分類とAI機能の評価
AIリスクレベルに応じた分類方法
AI医療機器のソフトウェア安全クラス分類では、AI機能が医療機器全体の安全性に与える影響を慎重に評価する必要があります。
クラスAは受容不能なリスクを生じない機能、クラスBは軽度の怪我や健康被害の可能性がある機能、クラスCは死亡や重篤な傷害につながる可能性がある機能に分類されます。画像診断支援AIの場合、診断の最終判断は医師が行うため、自動治療制御に関わるAIはクラスCとなる場合があります。
アイラト株式会社の放射線治療AI技術では、治療計画の立案支援という重要な機能を担うため、高度管理医療機器(クラスⅢ)での開発が求められます。


クラス別開発プロセスの違い
ソフトウェア安全クラスによって、必要な開発プロセスとドキュメントが段階的に定められています。
クラスが高くなるほど対応すべき要求事項が多くなり、最もリスクの大きいソフトウェアはクラスCに分類され、最も厳格な要件が課せられます。
エルピクセル株式会社の脳MRI解析ソフトウェア「EIRL aneurysm」は、頭部MRA画像から未破裂脳動脈瘤候補を検出し医師に提示する機能を持ち、2019年9月に薬事承認を取得しています。リスクレベルに応じた適切なクラス分類により、開発効率を向上させることも可能です。
設計開発プロセスへのAI特有要素の組み込み
学習データ管理とSOUPアイテムとしての扱い
AI医療機器では、学習データの品質管理が製品の性能と安全性に直結します。
アイラト株式会社は、国内のハイボリュームセンターから高品質な学習データを確保することで、優位性を確保しています。学習済みモデルはSOUP(Software of Unknown Provenance)として扱われ、その由来と性能特性を詳細に文書化する必要があります。
BioMindは、シンガポールのAIベンチャーと台湾の病院が共同開発した医療診断AIアルゴリズムを活用し、中国で最も厳しい安全性審査の「3類医療機器」登録承認を取得しました。学習データのバイアス、データセットの代表性、プライバシー保護も重要な考慮事項です。
- データの真正性確保:収集元の明確化と品質保証体制の構築
- バイアス検出と軽減:多様な患者集団からのデータ収集
- アノテーション品質:専門医による正確な教師データ作成
- プライバシー保護:個人情報の適切な匿名化処理
- 継続的品質管理:市販後学習データの品質監視体制
AIモデルのバリデーション要件
AI医療機器のバリデーションは、従来のソフトウェア検証とは異なる特殊な要件があります。
NTTデータは、米国の患者医用画像データベースを活用してAI画像認識技術を構築し、医療機関での実証実験を通じてソリューションを完成させました。性能評価では、感度、特異度、精度などの統計的指標に加えて、臨床的有用性の評価が必要です。
東医師が指摘するように、医師の診断効率化を目的としたAIデザインが実用化において重要な要素となります。クロスバリデーション、外部データセットでの検証、多施設での臨床評価など、多角的な検証アプローチが求められます。
感度、特異度、陽性的中率、陰性的中率などの統計指標による定量的評価。ROC曲線分析とAUC値の算出により、診断性能の客観的評価を実施。
医師の診断精度向上、診断時間短縮、見落とし率減少など、実際の臨床現場での有用性を定量的に評価。
開発に使用していない独立したデータセットでの性能確認。異なる医療機関、撮影機器、患者集団での汎化性能を検証。
市販後学習機能を持つAI医療機器の特別考慮事項
継続的な性能監視体制
市販後学習機能を持つAI医療機器では、継続的な性能監視システムの構築が不可欠です。
PMDAの報告書によると、市販後に性能を変化させることが可能なAI、特に機械学習を利用したSaMDの開発及び実用化促進が重要な課題となっています。性能監視では、診断精度の変化、新たなバイアスの発生、未知のエラーパターンの検出などを継続的に評価する必要があります。
東北大学病院とNECの共同実証実験では、生成AIによる医療文書作成において大幅な時間短縮効果を実現しながら、文章の表現や正確性も高く評価されています。このような成果を維持するためには、定期的な性能評価と必要に応じたモデル更新が重要です。
- リアルタイム性能監視:診断精度の継続的追跡
- バイアス検出システム:新たな偏見の早期発見
- 異常パターン検知:未知のエラーケースの特定
- 統計的品質管理:性能指標の統計的変化監視
- アラート機能:閾値逸脱時の自動通知システム
性能変化時の対応プロセス
AI医療機器の性能が許容範囲を超えて変化した場合の対応プロセスを事前に定義することが重要です。
厚生労働省のガイドラインでは、あらかじめ市販後に生じ得る性能変化水準を臨床上許容される範囲かつ統計学的な妥当性に基づいた範囲で目的に応じて規定しておくことが求められています。性能劣化の検出閾値、対応手順、関係者への通知方法、必要に応じた機能停止や制限措置などを明確化する必要があります。
アイラト株式会社の放射線治療AI技術では、治療の質が施設や医療スタッフの経験値に依存する課題を解決するため、一貫した品質管理システムの構築が重要視されています。市販後学習による性能向上と安全性確保のバランスを取るため、段階的な更新プロセスと十分な検証期間の設定が必要です。
統計的管理手法による性能指標の監視と、事前に設定した閾値を下回った場合の自動アラート機能を構築。
軽微な性能変化から重大な劣化まで、レベルに応じた対応手順を事前に策定。警告表示、機能制限、完全停止までの段階的措置を定義。
性能変化の程度に応じた報告義務の明確化と、PMDAへの迅速な報告体制の構築。必要に応じた承認変更手続きの準備。



バリデーションでは、統計的指標に加えて、医療現場での有用性・再現性の裏付けが評価の決め手になります。
開発ガイドラインとJIS T 2304の連携活用法
医用画像診断支援システム開発ガイドラインの活用
AI-CAD評価指標の具体的適用方法
医用画像診断支援システム開発ガイドラインは、AI-CAD(Computer-Aided Detection)システムの評価において具体的な指標を提供しています。
エルピクセル株式会社の「EIRL Colon Polyp」は、大腸内視鏡画像から大腸ポリープ候補を検出するシステムとして2022年11月に承認を取得し、このガイドラインに沿った評価を実施しています。感度(Sensitivity)、特異度(Specificity)、陽性的中率(PPV)、陰性的中率(NPV)などの統計的指標に加えて、臨床的有用性の評価が重要です。
富士フイルム株式会社の「FS-AI688型」では、CT画像からの肺結節検出において、これらの指標を用いた包括的な性能評価を実施しています。ROC曲線分析、AUC値の算出、信頼区間の設定など、統計学的に妥当な評価手法の適用が求められます。
- 感度(Sensitivity):真陽性率、病変を正しく検出する割合
- 特異度(Specificity):真陰性率、正常を正しく判定する割合
- 陽性的中率(PPV):検出した病変候補の中で実際に病変である割合
- 陰性的中率(NPV):正常と判定した中で実際に正常である割合
- AUC値:ROC曲線下面積による総合的な診断性能評価
性能評価とデータ特性の考慮点
AI医療機器の性能評価では、使用するデータセットの特性を十分に考慮する必要があります。
NTTデータの事例では、米国の患者データベースで構築したAIを日本人患者に適用する際、人種や体格の違いによる性能変化を慎重に検証しました。年齢分布、性別比、疾患の重症度分布、撮影条件の違いなど、様々な要因が性能に影響を与える可能性があります。
BioMindは、頭蓋内腫瘍の診断ソフトウェアにおいて、頭部、頚部、乳腺、血管、心臓など多様な部位に対応するため、各部位特有のデータ特性を考慮した評価を実施しています。多施設データでの検証、外部データセットでの性能確認、リアルワールドデータでの継続的評価が重要な要素となります。
- 人種・体格差:日本人特有の解剖学的特徴への対応
- 年齢・性別分布:患者集団の代表性確保
- 疾患重症度:軽症から重症まで幅広い症例での検証
- 撮影条件:異なる機器・設定での汎化性能確認
- 施設間差:多施設での実証による実用性評価
サイバーセキュリティ規格(JIS T 81001-5-1)との統合
AI医療機器特有のセキュリティリスク
AI医療機器は、従来の医療機器にはないサイバーセキュリティリスクを抱えています。学習データの改ざんによる性能劣化、敵対的攻撃(Adversarial Attack)による誤診断誘発、モデルパラメータの不正取得による知的財産侵害などが主要なリスクです。
厚生労働省は「医療機器のサイバーセキュリティの確保及び徹底に係る手引書」において、市販後のサイバーセキュリティリスク管理の重要性を強調しています。
東北大学病院の生成AI活用事例では、電子カルテ情報の機密性確保と外部システムとの安全な連携が重要な課題となっています。ネットワーク分離、暗号化通信、アクセス制御、監査ログの取得など、多層防御によるセキュリティ対策が必要です。
悪意のあるデータ注入によるモデル性能の意図的劣化。データ完全性の確保と異常データ検出システムの構築が必要。
入力データに微小な変更を加えることで誤診断を誘発する攻撃。入力データの検証と異常検知機能の実装が重要。
AIモデルの内部構造や学習済みパラメータの不正取得。アクセス制御の強化と暗号化による保護が必要。
SBOM(ソフトウェア部品表)の重要性
SBOM(Software Bill of Materials)は、AI医療機器のサプライチェーンセキュリティにおいて重要な役割を果たします。
2023年4月に改正された「基本要件基準」により、2024年4月以降はサイバーセキュリティ対応状況の確認が必須化されました。AI医療機器では、オープンソースライブラリ、学習済みモデル、データセットなど多様なコンポーネントが使用されるため、それぞれの由来と脆弱性情報を管理する必要があります。
アイラト株式会社のように、独自技術で差別化を図る企業でも、基盤となるソフトウェアコンポーネントの管理は重要です。SBOMには、コンポーネント名、バージョン、ライセンス情報、既知の脆弱性、依存関係などを含める必要があります。
- コンポーネント名称:使用するすべてのソフトウェア部品の正確な名称
- バージョン情報:各コンポーネントの具体的なバージョン番号
- ライセンス情報:オープンソースライブラリの利用条件
- 脆弱性情報:CVE番号による既知の脆弱性の記録
- 依存関係:コンポーネント間の相互依存性の明確化
- 更新履歴:パッチ適用やバージョンアップの記録



サイバー攻撃に対する脆弱性は、AI特有のモデル構造に起因するため、多層的な予防策と継続的監視体制が必要です。
AI医療機器開発における実践的な課題と解決策
技術的課題への対応アプローチ
データ不足・バイアス問題の解決方法
AI医療機器では、データ不足とバイアス問題が最も深刻な技術的課題の一つです。PMDAの報告書によると、AI医療機器の市販後学習時の性能評価において、学習データの品質管理が重要な課題として位置づけられています。
アイラト株式会社は、国内のハイボリュームセンターから高品質な学習データを確保することで、この課題に対処しています。データ拡張技術(Data Augmentation)、合成データ生成、転移学習(Transfer Learning)などの手法により、限られたデータから効果的な学習を実現できます。
BioMindの事例では、シンガポールと台湾の病院との国際連携により、多様な患者データを収集し、地域特性によるバイアスを軽減しています。
回転、拡大縮小、ノイズ付加などの手法により、限られた学習データから多様なパターンを生成。データ不足を補完し、モデルの汎化性能を向上。
複数の医療機関でデータを共有せずに協調学習を実施。プライバシーを保護しながら大規模データセットでの学習効果を実現。
統計的手法による学習データのバイアス検出と、多様な患者集団からのデータ収集による偏見の軽減。専門医による品質チェック体制の構築。
説明可能AI(XAI)の実装要件
医療分野では、AIの判断根拠を医師が理解できることが重要です。FDAが提案するGMLP(Good Machine Learning Practice)では、AI医療機器の透明性確保が重要な要件として位置づけられています。
エルピクセル株式会社は、ディープラーニングのブラックボックス性という課題に対して、十分な性能と裏付ける材料を揃えることで薬事承認を取得しました。Grad-CAM、LIME、SHAPなどの説明可能AI技術により、AIの判断根拠を可視化できます。
富士フイルム株式会社の画像診断支援システムでは、病変候補領域をヒートマップで表示することで、医師の理解を支援しています。
- Grad-CAM:畳み込みニューラルネットワークの注目領域可視化
- LIME:局所的な説明による個別予測の根拠提示
- SHAP:ゲーム理論に基づく特徴量重要度の定量化
- 注意機構:モデル内部の注目メカニズムの可視化
- ヒートマップ:病変候補領域の視覚的表示
規制対応の効率化戦略
専門人材の確保と組織体制構築
AI医療機器には、AI技術者、医学専門家、薬事規制専門家、品質管理専門家など多様な専門人材が必要です。厚生労働省の検討班報告書では、AI医療機器の開発・研究におけるデータ利用において、専門人材の育成と組織体制の重要性が強調されています。
アイラト株式会社の木村代表は、東北大学大学院での放射線治療AI技術開発と5年間の臨床業務経験を活かし、技術と臨床の両面から課題解決に取り組んでいます。医療AIプラットフォーム技術研究組合(HAIP)では、BIPROGY、日立ハイテク、IBM、ソフトバンクなど多様な企業が連携し、専門知識を共有しています。
- AI技術者:機械学習アルゴリズムの設計・実装・最適化
- 医学専門家:臨床ニーズの把握と医学的妥当性の評価
- 薬事規制専門家:承認申請戦略の策定と規制対応
- 品質管理専門家:QMSの構築と継続的改善の実施
- データサイエンティスト:学習データの品質管理と解析
- サイバーセキュリティ専門家:セキュリティ対策の設計・実装
品質マネジメントシステムの最適化
ISO 13485に基づく品質マネジメントシステムとJIS T 2304の統合により、効率的な開発プロセスを構築できます。
2024年4月以降、サイバーセキュリティ対応状況の確認が必須化されたことで、品質マネジメントシステムにセキュリティ要件も組み込む必要があります。NTTデータの事例では、病院の実態に合わせたきめ細かなソリューション改良により、実用化に向けた取り組みを実現しています。文書管理システムの電子化、トレーサビリティの自動化、リスク管理プロセスの標準化により、品質管理業務の効率化が可能です。
東北大学病院とNECの共同実証では、生成AIによる医療文書作成の自動化により、品質管理業務の負荷軽減を実現しています。



データの偏りと不足はAI医療機器の汎用性を損なう要因であり、拡張・転移学習や分散学習の活用が現実的な解法となります。
XAI技術は、医療現場でのAI活用を信頼性あるものにするための重要な要素であり、可視化設計が制度対応と実装品質の架け橋です。
開発効率化を実現するAI活用とツール導入
開発プロセス自動化によるコスト削減効果


文書作成・管理業務の効率化
AI医療機器では膨大な文書作成が必要ですが、生成AIの活用により大幅な効率化が可能です。医療AIプラットフォーム技術研究組合(HAIP)が2024年10月に策定したガイドラインでは、生成AIの8つのユースケースが示されており、文書作成支援もその一つとして位置づけられています。
東北大学病院とNECの共同実証実験では、診療記録や紹介状などの医療文書を電子カルテ情報から自動生成するAIにより、医師の文章作成時間が約50%短縮されました。設計仕様書、試験計画書、リスク分析書などの技術文書作成において、テンプレート自動生成、内容チェック、版数管理の自動化により、品質向上と工数削減を同時に実現できます。
ただし、生成AIの出力には不正確な情報が含まれる可能性があるため、専門家による確認プロセスの組み込みが重要です。
- 設計仕様書:テンプレート自動生成により作成時間を60%短縮
- 試験計画書:過去事例の自動参照により品質向上と時間短縮を実現
- リスク分析書:標準的なリスク項目の自動抽出と評価支援
- 申請書類:規制要件に基づく自動チェックと記載漏れ防止
- 品質管理文書:版数管理とトレーサビリティの自動化
テスト・検証プロセスの自動化
AI医療機器のテスト・検証プロセスでは、大量の医用画像データを用いた性能評価が必要です。
FDAが2024会計年度の医療機器関連ガイダンス計画案で示したように、AI/MLベースの医療機器ソフトウェア(SaMD)に対するサイバーセキュリティ管理策の適用が重要な課題となっています。
富士フイルム株式会社は、CT画像からの肺結節検出、COVID-19肺炎解析、肋骨骨折検出など複数のAI医療機器で薬事承認を取得しており、効率的なテストプロセスを確立していると考えられます。自動テストスイートの構築により、回帰テスト、性能ベンチマーク、統計的検証を自動化できます。
エルピクセル株式会社の複数の医療AI製品では、共通のテスト基盤を活用することで開発効率を向上させています。
- 継続的インテグレーション(CI):コード変更の自動テスト実行
- 継続的デプロイメント(CD):検証完了から本番環境への自動展開
- 性能ベンチマーク:統計的指標の自動算出と閾値監視
- 回帰テスト:既存機能への影響確認の自動化
- セキュリティテスト:脆弱性スキャンと侵入テストの自動実行
AI支援による規制対応の迅速化
規制要件チェックの自動化
JIS T 2304の複雑な要件に対する適合性確認は、AIツールにより効率化できます。2024年4月以降、サイバーセキュリティ対応状況の確認が必須化されたことで、規制要件チェックの重要性がさらに高まっています。
要件トレーサビリティマトリックスの自動生成、文書間の整合性チェック、必要書類の漏れ確認などをAIが支援することで、人的ミスを削減できます。医療AIプラットフォーム技術研究組合(HAIP)の取り組みでは、医療現場での生成AI導入促進のため、注意すべきポイントを明確化しています。自然言語処理技術により、規制文書の内容理解、要件抽出、適合性評価を自動化することが可能です。
アイラト株式会社のような研究開発型企業では、技術開発と並行して規制対応を進める必要があるため、このような自動化ツールの価値は特に高くなります。
システム要求からソフトウェア要求、設計、実装、テストまでの双方向トレーサビリティを自動生成。変更管理と影響分析を効率化。
複数の技術文書間での記載内容の整合性を自動確認。矛盾や不整合の早期発見により、審査での指摘事項を削減。
JIS T 2304の各要件に対する適合状況を自動評価。不足している文書や手順の特定により、承認申請前の準備を効率化。
申請書類作成支援システム
薬事申請書類の作成は専門性が高く時間のかかる作業ですが、AIによる支援により効率化が可能です。
PMDAの報告書によると、市販後の追加学習が可能なAIを利用したSaMDの実現可能性が検討されており、製造販売業者による段階的な追加学習と性能変化への対応が重要な課題となっています。過去の承認事例データベースを活用した類似事例検索、申請書類テンプレートの自動生成、記載内容の整合性チェックなどがAIにより実現できます。
BioMindが中国で取得した「3類医療機器」登録承認の経験は、国際的な申請書類作成のベストプラクティスとして活用できます。PMDAとの事前相談資料作成、臨床試験計画書の作成支援、市販後調査計画の策定においても、AIツールの活用により品質向上と工数削減が期待できます。



生成AIの導入により、文書作成や申請支援業務が大幅に効率化され、開発者が本来注力すべき技術開発に集中できる体制が整いつつあります。
成功事例から学ぶAI医療機器開発のベストプラクティス


国内外の承認取得事例分析
画像診断支援システムの開発事例
サイバネットシステム株式会社の「EndoBRAIN」シリーズは、日本のAI医療機器における先駆的な成功事例です。
2018年12月に承認された「EndoBRAIN」を皮切りに、「EndoBRAIN-EYE」(2020年1月)、「EndoBRAIN-UC」(2020年4月)、「EndoBRAIN-Plus」(2020年7月)と段階的に機能を拡張し、大腸内視鏡検査の包括的な診断支援システムを構築しました。この戦略では、基盤技術を確立した後に応用範囲を段階的に拡大することで、開発リスクを分散し効率的な承認取得を実現しています。
エルピクセル株式会社も同様のアプローチで、脳MRI解析「EIRL aneurysm」(2019年9月)、胸部X線解析「EIRL X-Ray Lung Nodule」(2020年8月)、大腸内視鏡解析「EIRL Colon Polyp」(2022年11月)と多様な画像診断領域で承認を取得しています。
- 基盤技術の確立:最初の製品で技術的な基盤を固める
- 段階的拡張:リスクを分散しながら機能を順次追加
- 共通プラットフォーム:開発効率の向上と品質の統一
- 臨床エビデンス蓄積:実臨床での有効性データの継続的収集
- 規制対応ノウハウ:承認プロセスの経験値蓄積
DTx(デジタル療法)の規制対応事例
アイリス株式会社の「nodoca(ノドカ)」は、2022年4月に新医療機器として承認された画期的な事例です。咽頭画像・体温・自覚症状等を解析してインフルエンザに特徴的な所見や症状を検出するシステムで、従来の画像診断支援とは異なる多モーダル解析を実現しています。
PMDAの報告書によると、機械学習を応用したSaMDの最大の特徴として、製品として上市した後も新たなデータを追加学習させることで性能を向上させることが可能なことが挙げられています。この事例では、複数の生体情報を統合的に解析するAIアルゴリズムの有効性と安全性を証明し、新たなカテゴリーの医療機器として承認を取得しました。
大阪国際がんセンターが計画している生成AIアバター医師による問診支援システムも、DTx領域での新たな可能性を示しています。
- 多モーダル解析:複数の生体情報を統合した診断支援
- 新規カテゴリー:従来にない医療機器分類での承認取得
- 臨床有用性:実際の医療現場での有効性実証
- 安全性確保:患者への直接的影響を考慮した設計
- 継続的改善:市販後学習による性能向上の仕組み
開発期間短縮と品質向上を両立した取り組み
アジャイル開発手法の適用
NTTデータの医療AI開発では、病院の実態に合わせたきめ細かなソリューション改良により、実用化を重視したアプローチを採用しています。PMDAの報告書では、市販後の追加学習が可能なAIを利用したSaMDの実現可能性が検討されており、製造販売業者による段階的な追加学習と性能変化への対応が重要な課題となっています。
東医師との議論を重ねる中で、当病院の患者ニーズや医師のワークフローに合わせたカスタマイズの重要性が確認され、共同開発が決定されました。このように、医療現場との密接な連携によるアジャイル開発手法は、AI医療機器において特に有効です。
短期間でのプロトタイプ開発、医師からのフィードバック収集、迅速な改善サイクルにより、市場ニーズに適合した製品開発が可能になります。
最小限の機能を持つMVP(Minimum Viable Product)を短期間で開発し、医療現場での実証実験を通じて基本的な有効性を確認。
医師や看護師からの使用感、診断精度、ワークフローへの影響などの詳細なフィードバックを定期的に収集し、改善点を特定。
2-4週間の短いスプリントで機能改善を実施し、継続的にユーザビリティと性能を向上。規制要件との整合性も並行して確認。
継続的インテグレーション・デプロイメント
AI医療機器では、モデルの継続的改善と品質管理の両立が重要です。FDAは2023年4月にAI/MLを利用したSaMDの機能に関する事前変更管理計画を含む規制枠組みを発表し、段階的な性能変化への対応を可能にしています。
東北大学病院とNECの生成AI活用事例では、電子カルテ情報からの医療文書自動生成において、継続的な性能評価と改善を実施しています。MLOps(Machine Learning Operations)の概念を医療機器に適用することで、モデル開発からデプロイメント、監視まで一貫したパイプラインを構築できます。
富士フイルム株式会社が複数のAI医療機器で承認を取得している背景には、共通の開発基盤と品質管理プロセスの確立があると考えられます。



段階的な機能展開と規制対応の両立は、日本におけるAI医療機器承認戦略の成功モデルとして広く参考にされています。
多モーダル解析や市販後学習対応といった次世代的な機能を持つ製品では、安全性と再学習の境界設計がカギとなります。
AI医療機器開発の将来展望と戦略的メリット


市場機会と競争優位性の構築
保険収載による収益性向上
AI医療機器の保険収載は、事業の持続可能性を決定する重要な要素です。政府は医師の診療を支援する医療用の国産生成AIの開発に着手し、学習規模を示すパラメーターは1720億程度となり、医療用の生成AIとしては世界最大規模となります。この取り組みにより、国内AI医療機器の保険収載への道筋が明確化されつつあります。
株式会社レイヤードが販売取り扱いを開始した「ボイスチャート」は、医師と患者の診察時の会話を録音し、SOAP形式のカルテテキストを自動生成することで、医師のカルテ作成時間を削減し、患者と向き合う時間を確保できます。
このような業務効率化に直結するAI医療機器は、保険収載の可能性が高く、安定した収益基盤の構築が期待できます。
- 安定収益:保険適用により医療機関の導入障壁が大幅に低下
- 市場拡大:全国の医療機関への普及が加速
- 競争優位:先行承認による市場シェア確保
- 投資回収:開発費用の確実な回収が可能
- 継続改善:収益を基盤とした技術開発の継続
グローバル展開への基盤構築
JIS T 2304に準拠した開発プロセスは、国際的な医療機器規制への適合性を高め、グローバル展開の基盤となります。
ヘルスケアサイバーセキュリティ市場は急速な成長が予測されており、医療機器のセキュリティ対策への投資が世界的に拡大しています。BioMindが中国で「3類医療機器」登録承認を取得した事例は、アジア市場への展開可能性を示しています。
メイヨークリニックでは、循環器科や神経科の情報に特化して学習させたAIモデルの開発を進めており、専門分野に特化したAI医療機器の国際的な需要が高まっています。また、生成AIが出した答えを読み取り、その答えが信頼できる内容かどうかを判断する別の生成AIを作る取り組みも進んでおり、AI医療機器の信頼性向上に向けた技術開発が加速しています。
- 国際標準準拠:複数国での同時承認取得が可能
- 技術ライセンス:知的財産の国際展開による収益化
- 戦略的提携:海外企業との協業による市場参入
- 規制ノウハウ:国際的な承認プロセスの経験蓄積
- スケールメリット:グローバル市場での競争力強化
技術革新がもたらす開発効率化の未来
生成AIを活用した開発支援
生成AIの活用により、AI医療機器の開発プロセス自体が大幅に効率化される可能性があります。
2025年春時点でのAI最新動向では、生成AIの普及が進む中、その安全性やセキュリティリスクについての議論が活発になっています。医療AIプラットフォーム技術研究組合(HAIP)の取り組みでは、生成AIの8つのユースケースが示されており、開発支援もその一つとして位置づけられています。コード生成、テストケース自動作成、文書作成支援、規制要件チェックなど、開発の各段階でAIが人間の作業を支援することで、開発期間の短縮と品質向上を同時に実現できます。
ただし、医療分野では間違いが絶対に許されないため、生成AIの出力に対する厳格な検証プロセスの確立が不可欠です。人間の専門知識とAIの処理能力を組み合わせることで、より高品質なAI医療機器の開発が可能になります。
機械学習アルゴリズムの実装コード自動生成、性能最適化の提案、バグ検出とデバッグ支援により、開発工数を大幅に削減。
エッジケースを含む包括的なテストケースの自動生成、回帰テストの効率化、品質保証プロセスの標準化を実現。
JIS T 2304要件への適合状況の自動確認、必要文書の漏れ検出、申請書類の品質向上支援を提供。
自動化技術による人材不足解決
医療分野の人材不足は深刻な課題ですが、AI技術の進歩により解決の糸口が見えてきています。世界の医療機器セキュリティ市場規模は、2023年に82億米ドルと評価され、サイバーセキュリティの研究開発への投資増加により、2024年から2032年にかけて8.9%のCAGRで成長すると予測されています。
NECと東京医科歯科大学が開発した慢性腰痛のセルフケア支援技術では、スマートフォンやタブレットで撮影した映像や問診データをAIで解析し、患者の自己管理を支援しています。このような技術により、医療従事者の負担軽減と患者の利便性向上を同時に実現できます。
AI問診システムの導入により、診察前の効率的な情報収集が可能となり、医師は診察に集中できるようになります。また、若手医師の育成支援においても、AIが過去の診断事例を体系的に学習させ、診断スキルの向上を支援することで、人材育成の効率化が期待されます。



生成AIの開発支援機能は、特に初期設計や検証フェーズでの工数削減に寄与し、人材不足の課題にも実務的な解を与えます。
JIS T 2304に準拠したAI医療機器開発に関してよくある質問
JIS T 2304はAI医療機器開発で必須ですか?
はい、JIS T 2304への適合は、日本でAI医療機器の薬事承認を取得するための必須要件です。
PMDAによる承認審査では、この規格への準拠が厳格に審査されます。エルピクセル株式会社やサイバネットシステム株式会社など、承認を取得した企業はすべてJIS T 2304に準拠した開発プロセスを実施しています。規格では、ソフトウェア安全クラス(A、B、C)に応じて必要なプロセスとドキュメントが段階的に定められており、AI特有の要素も考慮する必要があります。
AI特有の要件で最も重要なポイントは何ですか?
学習データの品質管理とSOUP(Software of Unknown Provenance)としての学習済みモデルの取り扱いが最も重要です。
BioMindやアイラト株式会社の事例が示すように、高品質な学習データの確保と適切な文書化が承認取得の鍵となります。また、説明可能AI(XAI)の実装により、AIの判断根拠を医師が理解できるようにすることも重要な要件です。継続的な性能監視体制の構築と、市販後学習機能を持つ場合の安全性確保も欠かせません。
市販後学習機能を持つAIの承認は可能ですか?
はい、適切な安全管理措置を講じることで承認は可能です。
PMDAの報告書によると、市販後の追加学習が可能なAIを利用したSaMDの実現可能性が検討されており、製造販売業者による段階的な追加学習と性能変化への対応が重要な課題となっています。
ただし、継続的な性能監視システムの構築、性能変化時の対応プロセスの明確化、規制当局への報告体制の整備が必要です。性能劣化の検出閾値、対応手順、必要に応じた機能停止措置などを事前に定義し、承認申請時に提出することが求められます。
開発期間とコストはどの程度必要ですか?
AI医療機器の開発には、通常3-7年の期間と数億円以上の資金が必要です。
医療機器へのAI/ML技術の導入は加速しており、診断支援から治療計画まで幅広い分野での活用が期待されています。富士フイルム株式会社やエルピクセル株式会社の事例を見ると、基盤技術の確立から承認取得まで長期間を要しています。
開発コストには、学習データの収集・整備、臨床試験の実施、規制対応、品質管理システムの構築などが含まれます。ただし、段階的な機能拡張戦略や共通基盤の活用により、2製品目以降の開発効率化が可能です。
既存のAIモデルを医療機器に組み込む際の注意点は?
既存のAIモデルはSOUP(Software of Unknown Provenance)として扱われ、その由来、性能特性、制限事項を詳細に文書化する必要があります。
NTTデータの事例のように、米国のデータベースで構築したAIを日本人患者に適用する際は、人種や体格の違いによる性能変化を慎重に検証する必要があります。また、オープンソースライブラリや学習済みモデルを使用する場合は、SBOM(ソフトウェア部品表)による管理と、定期的な脆弱性チェックが重要です。
医療機器としての安全性と有効性を独自に検証し、必要に応じてモデルの再学習や調整を行うことが求められます。ヘルスケア分野におけるAI技術の市場は継続的な拡大傾向にあり、医療の質向上と効率化への貢献が注目されています。市場の急速な拡大により既存技術の活用機会も増加しています。




