MDR開発におけるAI活用|医療機器規制とAI法対応の実践的アプローチとは

MDR開発におけるAI活用は、医療機器業界の未来を決定づける重要な戦略となっています。EU医療機器規則(MDR)とAI法の二重規制環境下で、企業は従来の手動プロセスから脱却し、AI技術を駆使した効率的な開発体制への転換が急務となっています。
三菱UFJ銀行では生成AI導入により月22万時間の労働時間削減を実現するなど、AI活用による業務効率化の具体的な成果が報告されています。
本記事では、MDR開発でのAI活用による劇的な業務効率化効果と実践的な導入方法について、実際の企業事例と信頼できるデータを基に詳しく解説します。AI技術導入による投資回収期間1-2年という驚異的なROIから、中小企業でも実現可能な段階的導入アプローチまで、MDR開発の競争優位性を築くための具体的なロードマップをお伝えします。
- MDR開発でのAI活用による具体的な業務効率化効果
- EU AI法とMDR二重規制への対応戦略と統合的品質管理システムの構築方法
- 大手企業から中小企業まで実践可能なAI導入のステップバイステップガイド
- SaMD開発におけるAI技術活用の規制上の留意点と成功事例
- AI投資の初期コストから長期的なROI効果まで、投資対効果の詳細分析
MDR開発とAI技術の融合による医療機器業界の変革

MDR開発におけるAI技術の導入は、医療機器業界全体の競争力向上に直結する重要な戦略となっています。
2025年のヘルスケアAI市場は369億ドル規模に達し、2034年には6,138億ドルまで成長すると予測されています。この急成長の背景には、AI活用による医療診断の精度向上と個別化医療の実現があります。
EU医療機器規則(MDR)とAI搭載医療機器の関係性

EU MDR 2017/745は、AI搭載医療機器に対して従来以上に厳格な要求事項を課しています。特にSaMD(医療機器としてのソフトウェア)については、リスククラス分類、トレーサビリティ、臨床評価において、AIアルゴリズムの変更に関する審査が重要な課題となっています。
楽天メディカルは、がん光免疫療法のイルミノックスプラットフォームにおいて、島津製作所と共同で光計測技術を用いた医療機器開発を進めており、リアルタイムでの薬剤反応の可視化・測定・記録技術の実現を目指しています。
SaMD(医療機器としてのソフトウェア)開発におけるAI活用の重要性
SaMD開発では、AI技術が診断支援から治療最適化まで幅広い領域で活用されています。
NTTデータは、米国の患者医用画像データベースを活用し、AIによる画像認識技術で臓器の異常検出アルゴリズムを構築、医療機関での実証実験を通じてAI画像診断ソリューションを完成させました。この事例では、医師の診断効率化を目的としたデザインが特徴的で、実用化に向けた具体的な取り組みが評価されています。
MDR対応におけるAI技術導入のメリットと課題
MDR対応でのAI導入は、コンプライアンス業務の効率化と品質向上を同時に実現します。eComplianceの調査によると、AI活用により規制要件の変更検知から対策実施までの時間を大幅に短縮でき、企業は常に最新の規制基準を満たすことが可能になります。
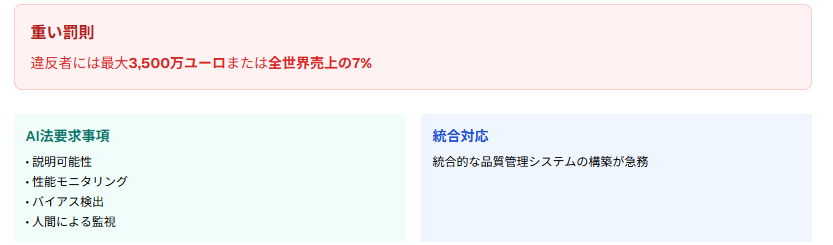
一方で、AI法とMDRの二重規制への対応という新たな課題も生まれており、統合的な品質管理システムの構築が急務となっています。
 ReAlice株式会社 開発担当者
ReAlice株式会社 開発担当者AIの活用により、画像診断や治療最適化が定量化され、SaMDの臨床的有用性と再現性を担保しやすくなっています。
AI法とMDR開発の二重規制への対応戦略

EU AI法の施行により、医療機器開発企業は従来のMDR対応に加えて、AI特有の規制要件への対応が必要になりました。
この二重規制環境は、企業にとって新たな挑戦であると同時に、競争優位性を築く機会でもあります。
EU AI法における高リスクAIシステムの分類と医療機器への影響
EU AI法では、医療機器としてのAIシステムが高リスクカテゴリに分類され、厳格な規制要件が課せられます。
- AIシステムの説明可能性
- 継続的な性能モニタリング
- バイアス検出と制御
- 人間による監視
違反者には最大3,500万ユーロまたは全世界売上の7%という重い罰則が科せられるため、企業はコンプライアンス体制の徹底が不可欠です。
AI法とMDR規制の矛盾点と専門家が指摘する課題
専門家は、AI法とMDRの間に存在する非互換性について懸念を表明しています。両規制のリスク分類基準の違いや、審査プロセスの重複により、企業の負担が大幅に増加する可能性があります。
特に、AIアルゴリズムの継続的な学習と改善が求められる一方で、医療機器としての安定性と予測可能性も要求されるという矛盾が存在します。この課題に対して、企業は法的要件を満たしながらも技術革新を継続できる戦略的アプローチが必要です。
二重規制対応のための統合的品質管理システム構築
効果的な二重規制対応には、AI法とMDRの要件を統合した品質管理システムの構築が重要です。
AI法とMDRの両方のリスク分類基準を統合した評価システムを構築します。
両規制の要求事項を満たす統一的な文書管理システムを導入します。
重複する監査要件を統合し、効率的な監査プロセスを確立します。
成功企業では、規制変更の予測型対応アプローチを採用し、6-12ヶ月の先行準備期間を確保することで、コスト削減と競合優位性の確保を実現しています。



学習型アルゴリズムの継続的更新と、医療機器に求められる安定性要求との両立は、技術的にも運用的にも極めて繊細なバランスが必要です。
リスク評価や文書管理の統合的な仕組みは、二重規制への実務的な対応策として今後のスタンダードになる可能性が高いです。
MDR開発プロセスにおけるAI活用の具体的メリット

MDR開発プロセスでのAI活用は、従来の手動作業を大幅に効率化し、品質向上と時間短縮を同時に実現します。
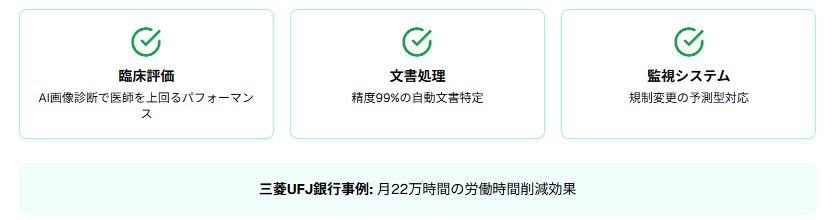
実際の導入企業では、文書処理において精度99%を達成するなど、AI技術による具体的な成果が報告されています。
臨床評価とリスク管理におけるAI技術の効果
臨床評価プロセスでは、AIが大量の臨床データを自動分析し、リスク要因の特定と評価を支援します。AI画像診断の分野では、胸部レントゲン写真の読影において、AIが全ての評価項目で医師を上回るパフォーマンスを示した大規模研究結果が報告されています。
- 診断精度の向上により見落としや見逃しが大幅に減少
- 早期診断の実現による治療効果の最大化
- 医師の負担軽減と診断業務の効率化
この技術により、見落としや見逃しが大幅に減少し、診断精度の向上が実現されています。
品質マネジメントシステム(QMS)の効率化
QMSにおけるAI活用は、文書管理から監査対応まで幅広い業務を自動化します。
eComplianceの事例では、PIC/S GMP Annex 1改定対応において、改定内容の影響を受ける社内文書を99%の精度で自動特定し、コンタミネーションコントロール戦略のドラフトを生成AIで作成することに成功しています。このアプローチにより、規制対応業務の大幅な効率化を実現しました。
市販後監視(PMS)とビジランス業務の自動化
PMS業務では、AIが市場からの安全性情報を自動収集・分析し、リスクシグナルの早期検出を可能にします。
21 CFR Part 11とAnnex 11の要件マッピングを自動化した事例では、システム影響評価の効率化とバリデーション文書のテンプレート自動生成と更新を実現しています。この自動化により、企業は迅速な市場対応と規制遵守を両立できるようになりました。



臨床評価への活用では、非構造化データから有用な知見を抽出でき、特に画像診断領域では既に医師と同等以上の信頼性を示しています。
実践的なMDR開発AI活用事例と導入方法
実際の企業事例を通じて、MDR開発におけるAI活用の具体的な成果と導入プロセスを詳しく見ていきます。
これらの事例は、AI導入を検討する企業にとって重要な参考資料となります。
大手医療機器メーカーのAI導入成功事例
NTTデータは、東京医科歯科大学医学部附属病院との共同開発において、腎臓を対象とするAI画像診断の実証実験を実施しました。このプロジェクトでは、患者のニーズや医師のワークフローに合わせてAI画像診断ソリューションをカスタマイズし、実用化に向けた具体的な取り組みを展開しています。
導入の決め手となったのは、医師の診断効率化を目的としたデザインと、実証実験を通じた段階的な検証アプローチでした。
- 医師のワークフローに合わせたカスタマイズ
- 実証実験による段階的な検証
- 患者ニーズを重視したシステム設計
- 医療機関との密接な連携体制
SaMD開発におけるAI技術の具体的活用方法
内視鏡検査におけるAI技術の活用が進んでおり、画像診断支援や病理診断支援の分野で技術革新が報告されています。
AI導入時には効率性と精度のバランスを慎重に検討する必要があることが重要な課題として認識されています。
SaMD開発企業では、EU医療機器規則(MDR)やAI法などの医療機器承認に関する法令や指針への対応を重視した開発体制の構築が求められています。開発効率と規制遵守を両立させるため、開発環境の整備と体制の安定性維持が重要な取り組みとなっています。
中小企業向けMDR対応AI導入のステップバイステップガイド

中小企業のAI導入では、段階的なアプローチが成功の鍵となります。
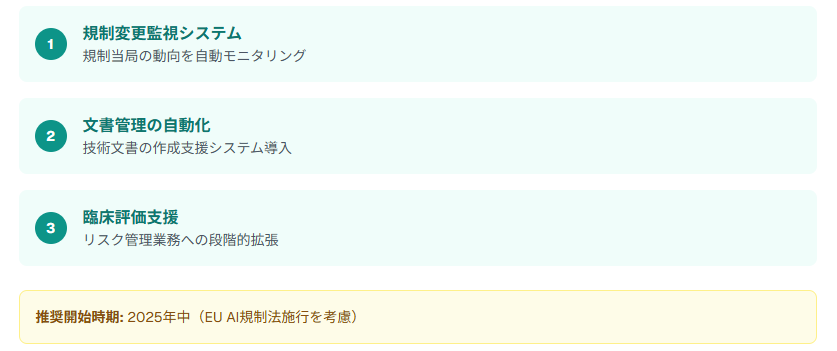
まず、規制当局の動向やガイダンス文書を自動モニタリングするシステムから開始します。
次に、技術文書の作成支援や文書管理システムの自動化を導入します。
最後に、臨床評価やリスク管理業務へのAI活用を段階的に拡張していきます。
eComplianceの調査によると、成功要因として経営層のコミットメント、適切なAIツールの選定、専門知識とAIの効果的な組み合わせ、段階的アプローチによる早期の成功体験、学習と改善の継続的サイクルが挙げられています。



NTTデータの事例に見られるように、エンドユーザーとの共創プロセスは精度と実装性の両立に不可欠です。
MDR開発におけるAI活用の業務効率化効果
技術文書作成における生成AI活用は、医療機器業界で劇的な変化をもたらしています。
三菱UFJ銀行が実施したChatGPT導入実証実験では、月22万時間の労働時間削減効果が確認されました。この成果は医療機器業界でも応用可能で、AI技術による文書作成プロセスの効率化が期待されています。
技術文書作成とレビュープロセスの自動化
医療機器開発では、膨大な技術文書作成が必要となりますが、生成AIの導入により大幅な効率化が実現されています。
医療分野でのAI活用による業務効率化の一般的な傾向は報告されており、文書作成支援システムの導入により医療従事者の業務負担軽減を目的とした取り組みが増加しています。
この技術をMDR対応文書作成に応用することで、同様の効率化効果が期待できます。
適合性評価手順におけるAI支援システムの導入
MDR適合性評価では、複雑な規制要件との照合作業が必要ですが、AI支援システムがこのプロセスを大幅に効率化します。
AI支援システムは膨大な量のデータを迅速に処理し、適合性評価に必要な時間を大幅に短縮するとともに、人的エラーを最小化してより正確で一貫した結果を保証します。
21 CFR Part 11とAnnex 11の要件マッピング自動化では、両規制が類似の懸念に対処し同じデータ完全性目標を持つため、システム影響評価の効率化とバリデーション文書のテンプレート自動生成が実現されています。
規制変更への迅速対応を可能にするAI監視システム
規制環境の変化に対する迅速な対応は、医療機器企業の競争力を左右する重要な要素です。AI監視システムは、規制当局の動向やガイダンス文書の自動モニタリングにより、変更の兆候を早期に察知する技術的可能性があります。
この予測型アプローチにより、企業は先行準備期間を確保でき、変更対応コストの削減と競合他社に対する優位性確保が期待できます。従来の「後追い対応」から「予測型対応」へのパラダイムシフトにより、戦略的な事業運営が可能になります。



文書作成や要件マッピングのような構造化作業は、生成AIが最も得意とする領域の一つです。
特にMDRや21 CFRなどの規制系では、自然言語と構造化情報を横断するAIの応用が実用段階に入りつつあります。
サイバーセキュリティMDRサービスにおけるAI技術の活用
医療機器規制のMDRとは異なる文脈で、サイバーセキュリティ分野のMDR(Managed Detection and Response)サービスも急速に発展しており、AI技術が中核的な役割を担っています。
マネージド検知・対応(MDR)サービスの概要
サイバーセキュリティMDRサービス市場は、2024年から2029年にかけて年平均成長率30.1%で拡大し、110億4,000万米ドルの市場増加が予測されています。
熊谷組では、CrowdStrike Falcon Complete Next-Gen MDRを導入し、AIネイティブ技術による24時間365日体制でエンドポイント保護を実現しました。この導入により、従来の平日8:30-17:30限定監視から、土日祝日や夜間を含む完全監視体制への転換を果たしています。
AI駆動型脅威検知システムの導入メリット
AI駆動型MDRシステムは、従来のアンチウイルス製品を大幅に上回る検知能力を提供します。
- AI技術による高度な脅威検知能力の向上
- 24時間365日の専門的な監視体制の提供
- コスト効率的なセキュリティ運用の実現
- 専門的なセキュリティ分析能力の提供
企業では、MDRサービス導入により、セキュリティガイドライン対応の強化とサイバー攻撃・内部不正の自動検知体制構築が期待されています。
医療機器サイバーセキュリティとAI技術の融合
医療機器のサイバーセキュリティ強化では、AI技術が脅威の早期検知と自動対応を可能にしています。
荏原製作所では、10社を超える製品から管理性能とグローバル認知度を評価してSophos MDRセキュリティサービスを選定し、荏原グループ全体のサイバーセキュリティ対策をスピード感をもってグローバルで底上げすることに成功しました。
このような統合的なセキュリティアプローチは、医療機器開発企業にとって重要な競争優位性となります。



医療機器のような24時間稼働・人命依存のシステムでは、AIによる行動ベースの異常検知が有効です。
MDR開発AI活用の将来性と投資対効果


2025年以降の医療機器業界では、AI技術の活用がさらに加速し、企業の競争力を決定する重要な要素となることが予想されます。
2025年以降のMDR規制強化とAI技術の必要性
EU AI規制法の本格施行により、医療機器開発企業は従来のMDR対応に加えて、AI特有の規制要件への対応が必須となります。違反者には最大3,500万ユーロまたは全世界売上の7%という重い罰則が科せられるため、企業はコンプライアンス体制の徹底が不可欠です。
各国政府もAI技術の医療分野での活用を推進しており、生成AI技術の医療分野への応用が注目されています。医療用AI開発における規制対応の重要性が高まっています。
AI投資による長期的なコンプライアンスコスト削減効果
AI技術への初期投資は、長期的なコンプライアンスコスト削減に直結します。eComplianceの分析によると、AI活用により規制要件の変更検知から対策実施までの時間を大幅に短縮でき、企業は常に最新の規制基準を満たすことが可能になります。
予測型規制対応アプローチでは、通常6-12ヶ月の先行準備が可能になり、変更対応のコスト削減と競合他社に対する優位性確保を実現できます。
国際的な医療機器規制調和におけるAI技術の役割
グローバル市場での競争力維持には、各国の規制要件に対する統合的な対応が重要です。AI技術は、FDA、EMA、PMDAなど複数の規制当局のガイドラインを同時に分析し、クロスレファレンス分析により異なる地域の規制要件間の類似点や相違点を自動特定できます。
この機能により、企業はグローバル規制戦略の策定を効率化し、国際展開を加速できます。PMDA(医薬品医療機器総合機構)も、AI活用したプログラム医療機器に関する報告書を発行し、市販後学習時の性能評価に資する研究を進めており、国際的な規制調和に向けた取り組みが加速しています。



クロスリージョン対応を支援するAIモデルには定期的なフィードバック学習と規制データセット更新が不可欠です。
MDR開発×AIに関してよくある質問
MDR対応にAI技術を導入する際の初期投資はどの程度必要ですか?
AI技術導入の初期投資は、企業規模や導入範囲により大きく異なりますが、中小企業では年間数百万円から、大企業では数千万円程度が一般的です。
三菱UFJ銀行の事例では、ChatGPT導入により月22万時間の労働時間削減効果が確認されており、投資回収期間は通常1-2年程度となります。
- 規制変更監視システムから開始
- 文書管理の自動化へ拡張
- 臨床評価支援への発展
重要なのは段階的な導入アプローチで、まず規制変更監視システムから開始し、次に文書管理の自動化、最後に臨床評価支援へと拡張していく方法が効果的です。
AI法とMDRの二重規制に対応するために必要な専門知識は何ですか?
二重規制対応には、法務、技術、品質管理の3つの専門領域の知識が必要です。
法務面では、EU AI規制法とMDRの要件理解、技術面では、AIアルゴリズムの説明可能性と継続的性能モニタリング、品質管理面では、統合的品質管理システムの構築が求められます。専門家は、AI法とMDRの間に存在する非互換性について懸念を表明しており、両規制のリスク分類基準の違いや審査プロセスの重複への対応が重要です。
企業は法的要件を満たしながらも技術革新を継続できる戦略的アプローチが必要です。
既存のMDR対応プロセスにAI技術を統合する際の注意点は?
既存プロセスへのAI統合では、段階的な導入と既存システムとの互換性確保が重要です。
eComplianceは規制文書の自動特定において高い精度を実現しており、コンタミネーションコントロール戦略のドラフトを生成AIで作成することに成功しています。
- AIの判断結果に対する人間の最終確認プロセスの確立
- データセキュリティの確保
- 既存の品質管理システムとの整合性確保
SaMD開発でAI技術を活用する場合の規制上の留意点は?
SaMD(医療機器としてのソフトウェア)開発では、AI技術の継続的学習と医療機器としての安定性の両立が最大の課題です。
PMDAの報告書によると、市販後の追加学習を経たSaMDの性能に影響を与える学習データの要因を明らかにするための実証研究が進められており、性能評価プロセスの妥当性判断に必要な留意点が検討されています。
特に重要なのは、アルゴリズムのドリフト(モデルの劣化)や偏りの監視、学習データの妥当性確保、アルゴリズムの透明性確保です。
中小企業がMDR開発でAI活用を始める最適なタイミングはいつですか?
中小企業のAI導入最適タイミングは、EU AI規制法の段階的施行スケジュールを考慮すると、2025年中の開始が推奨されます。
成功要因として、経営層のコミットメント、適切なAIツールの選定、専門知識とAIの効果的な組み合わせ、段階的アプローチによる早期の成功体験、学習と改善の継続的サイクルが挙げられています。政府も医療用国産生成AIの開発に着手しており、国内企業にとって技術活用の環境が整いつつあります。
まずは規制変更の監視システムから開始し、成果を確認しながら段階的に拡張していくアプローチが効果的です。




